概述
选择性地将靶蛋白从细胞中去除而不是抑制靶蛋白活性,是一种新的潜在治疗方法。靶蛋白通过细胞内的天然泛素-蛋白酶体系统(UPS)被降解。如”分子胶”和蛋白水解靶向嵌合体(PROTACs)等这类的化合物通过将靶蛋白与E3连接酶连接来启动这一过程,剩下的过程就由UPS来完成。
Promega利用灵敏的生物发光技术,提供使用CRISPR编辑的细胞系池和克隆的综合选择,以便于研究当下热点的蛋白质降解靶标。
利用蛋白降解治疗“无成药性靶点”
蛋白降解类药物研发过程中需考虑的关键问题
Promega为您提供细胞水平的完整分析解决方案,用于开发有效的蛋白质降解剂。这些产品用于回答以下关键问题:

检测靶蛋白是否成功降解
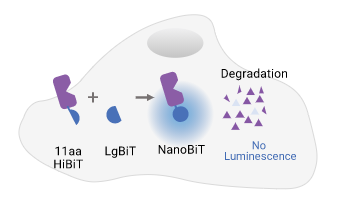
| HiBiT技术能够定量分析蛋白降解类药物的功能。HiBiT是一个11个氨基酸的多肽标签,与它的互补伴侣LgBiT具有很高的亲和力。它们共同组成了二亚单元发光蛋白,NanoBiT®萤光素酶。当使用CRISPR基因编辑技术将HiBiT引入内源性位点时, HiBiT- LgBiT一经结合,有活性的萤光素酶蛋白便产生了与内源性靶蛋白水平相关的非常明亮且高灵敏的读数。 添加能引起降解的化合物会导致发光信号的丢失,这个过程可以是高度定量和实时测量的。在24- 48小时内可以获得细胞的剂量响应曲线并进行实时监测,从而可以准确测定降解速率、Dmax、DC50值和蛋白水平恢复。 这种方法允许对一系列不同的降解参数进行快速排序,并且该方法适用于高通量筛选。 | 细胞内的HiBiT融合蛋白与LgBiT互补的示意图。 |
| | 蛋白降解的活细胞成像。MZ1(BET溴结构域降解剂)处理后,CRISPR-HiBiT BRD4细胞的延时成像。BRD4在2小时后一致消失。使用奥林巴斯LV200系统进行成像。 |
| | |
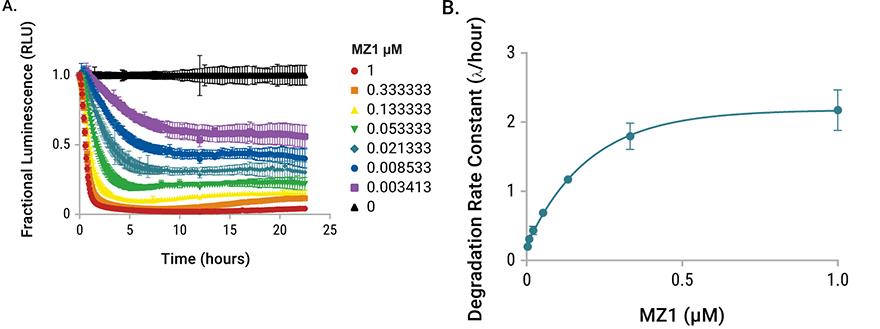
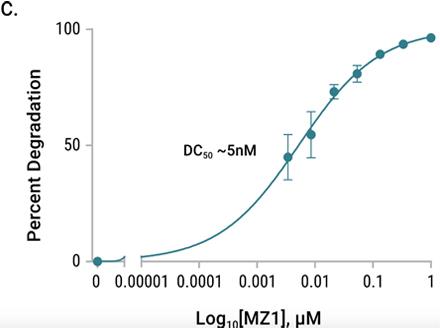 | PROTAC处理后的内源性HiBiT-BRD4降解动力学研究。将HiBiT插入至HEK293 LgBiT细胞系的内源性BRD4位点。细胞在含有Nano-Glo® Endurazine™ substrate的不依赖二氧化碳的培养基中用MZ1滴定处理。图A:动力学发光检测;图B:降解速率;图C: Dmax。 |
Study protein degradation in real time using CRISPR knock-in cell lines and clones
检测三元复合物的形成
| E3三元复合物(包括靶标蛋白、降解化合物和E3连接酶)的形成可能是靶标蛋白降解过程中最关键的步骤。这一步是开发和优化有效降解化合物的关键参数。NanoBRET™技术非常适合研究活细胞形式的三元复合物形成,同时适用于终点法检测或动力学分析。 | 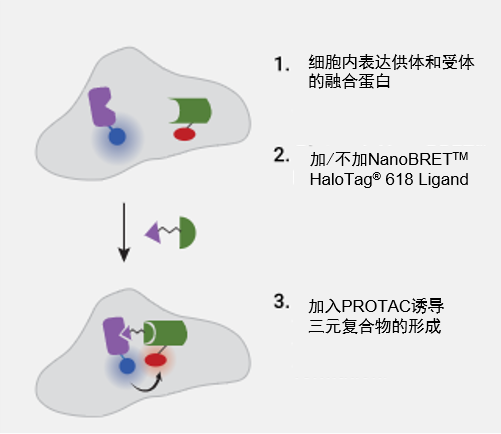 NanoBRET™三元复合物形成示意图。 |
利用活细胞终点法检测PROTAC诱导的BRD4 VHL/CRBN三元复合物的形成和BRD4蛋白水平。NanoLuc®-BRD4供体质粒与HaloTag®-VHL或HaloTag®-CRBN受体质粒以1:100的比例转染细胞(BRD4 /VHL检测),用MG132预处理(或DMSO作为对照),随后再用1µM MZ1 (基于VHL的PROTAC)或DMSO溶液处理。NanoBRET™比率表明三元复合物形成(图A), NanoLuc®发光检测表明PROTAC处理导致的靶蛋白水平变化(图B)。
PROTAC处理后BRD4/VHL三元复合物形成的动态监测。通过CRISPR/Cas9基因编辑,将HiBiT插入到HEK293 LgBiT细胞系的内源性BRD4位点。用HaloTag®-VHL受体质粒转染稳定的克隆。在PROTAC处理前,用MG132预处理细胞。使用NanoBRET™ Nano-Glo® Kinetic Detection System 检测NanoBRET™信号,实时监测三元复合物的形成。
检测靶标蛋白泛素化作用
| NanoBRET™技术可用于靶标蛋白泛素化动力学检测或是终点法检测模式,可用于测量化合物剂量-响应曲线等应用。 在NanoBRET™泛素化检测中,靶标蛋白作为能量供体,并在细胞中与外源性瞬时的NanoLuc®融合表达,或在表达LgBiT的细胞中与内源性标记的HiBiT融合表达。外源性表达的HaloTag-Ub作为能量受体。活细胞NanoBRET™检测的实时性可使用终点法或动力学分析。与三元复合物的形成类似,泛素化的变化一般发生在化合物添加后的1 ~ 4小时内。 | 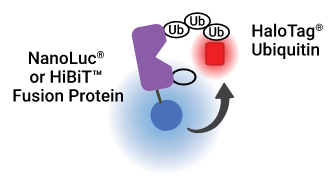 NanoBRET™-泛素复合物示意图。 |
| | |
| BRD4泛素化的动力学监测。通过CRISPR/Cas9基因编辑,将HiBiT插入到HEK293 LgBiT细胞系的内源性BRD4位点。用HaloTag®-Ubiquitin受体质粒转染稳定的克隆。细胞经1μM MZ1或1μM dBET1处理后,使用NanoBRET™ Nano-Glo® Kinetic Detection Reagent测定靶标蛋白随时间的泛素化作用。 | 使用活细胞终点法检测PROTAC处理后的BRD4泛素化。用NanoLuc®-BRD4和HaloTag®-Ubiquitin质粒转染HEK293细胞,供体与受体的比例为1:100,在HaloTag® NanoBRET™ 618 Ligand存在下进行处理,用10μM dBET1或MZ1 PROTAC化合物梯度稀释后处理1小时。对于这两种PROTACs,都观察到BRET比率呈现剂量依赖性增加。误差线表示标准偏差,n = 3。 |
判断PROTAC的透膜性和与靶点亲和力
| 在开发降解化合物时,评估它们的细胞透膜性以及对靶标蛋白和E3连接酶的亲和力是很重要的。NanoBRET™ Target Engagement (TE) Assays能够测量活细胞中的蛋白质-小分子结合的相互作用,提供定量测定化合物亲和力和靶蛋白占有率的方式。 NanoBRET™ TE检测利用NanoLuc®萤光素酶标记的靶标蛋白和细胞透膜性的荧光NanoBRET ™示踪剂的生物发光共振能量转移(BRET)。当示踪剂在细胞中可逆地与靶蛋白-NanoLuc®融合蛋白结合时,BRET通过从NanoLuc®标记的靶蛋白到细胞透膜性荧光示踪剂的发光能量转移实现。靶标结合是通过化合物与NanoBRET™示踪剂的竞争性来检测的,而这通常会导致BRET的丢失。这种检测方法可以测定化合物的细胞亲和性,并且可以实现仅需加样,具有可扩展性,兼容多孔板的操作方式。 滞留时间是SAR研究中一个重要的参数,以监测提高降解效能的过程。NanoBRET™ TE检测可以配置为动力学模式,以了解化合物对其靶标蛋白的滞留时间。 | 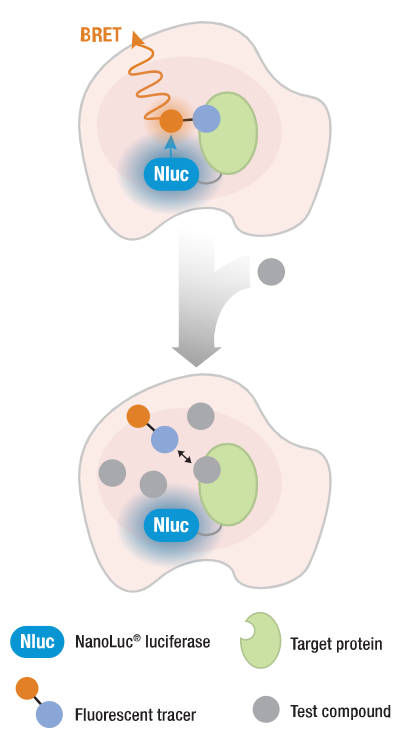 NanoBRET™ target Engagement Assay原理图。 |
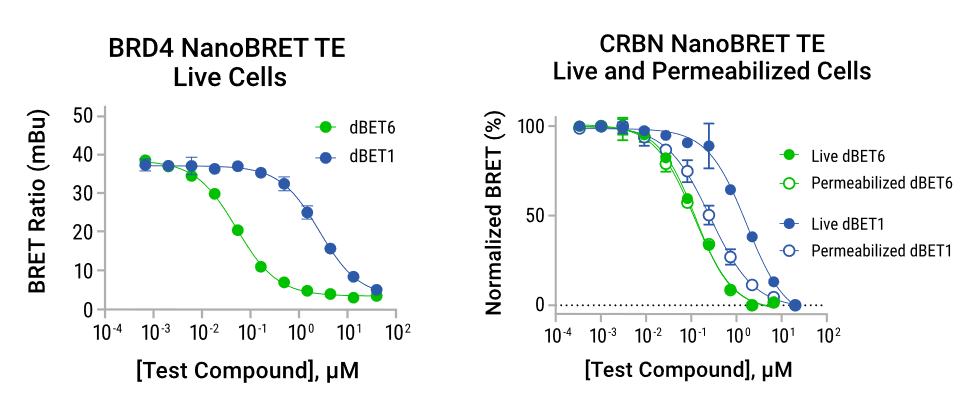
使用NanoBRET™ TE检测测定靶向BRD4的BET降解物的细胞亲和力。使用BRD4 NanoBRET™ TE检测比较两个靶向BRD4相关的PROTACs的细胞结合亲和力(左图)。使用NanoBRET™ TE CRBN检测在活细胞和渗透性细胞中比较E3连接酶CRBN的降解亲和力,评估化合物透膜性对测定结合亲和力的贡献(右图)。研究发现,dBET6比dBET1具有更强的透膜性,dBET6对CRBN的亲和力略高于dBET1。
靶标蛋白降解后的表型分析
| 与基因敲除或蛋白突变相比,细胞内蛋白质的短暂降解通常会引起一种完全不同的表型。HaloPROTAC-3是HaloTag®标签与PROTAC的融合小分子,是了解和表征蛋白质降解表型的一种快速高效的方法。 HaloPROTAC-3将内源性VHL E3连接酶组分引入HaloTag®融合蛋白,通过蛋白酶体途径实现泛素化降解。HaloPROTAC包含一个诱导降解的酰胺部分,通过可变长度的连接物与氯化烷烃结合。 为了研究相关细胞背景下的内源性蛋白减少,我们建议通过CRISPR/Cas9基因编辑技术将HaloTag®或HiBiT-HaloTag®标签整合到靶标蛋白位点。使用HaloTag®单克隆抗体(用于HaloTag®标签)或活细胞发光法(使用HiBiT-HaloTag®标签) 监测HaloPROTAC-3处理的细胞中蛋白质的减少情况。HaloPROTAC-3显示了内源性标记的HaloTag®融合蛋白随着时间的推移而持续的快速降低。 | 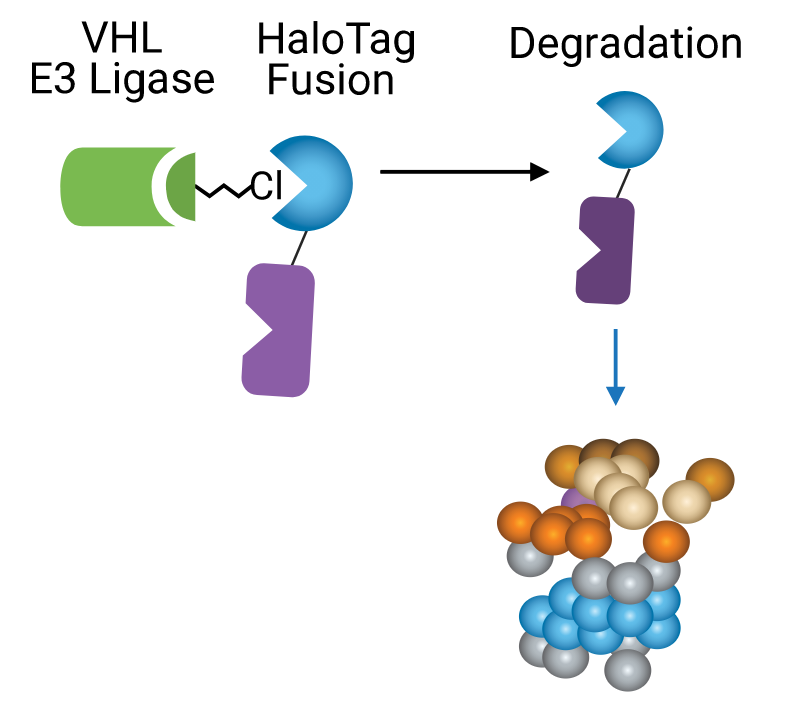 HaloPROTAC功能概述原理图。 |
| | |
| HaloPROTAC-3结构图。分子中诱导降解的酰胺部分通过灵活的三醚连接物偶联到氯化烷烃部分。 | HiBiT-BRD4降解机制。内源性标记HiBiT和HaloTag®标签的BRD4,通过HaloPROTAC浓度的增加发生降解,并使用HiBiT发光检测进行定量。 |
HaloPROTAC3与dTag技术在2020年的Cell paper: Protelysis-Targeting Chimeras as Therapeutics and Tools for Biology Discovery (https://doi.org/10.1016/j.cell.2019.11.031)中进行了比较。该篇文章介绍了蛋白水解靶向嵌合体(PROTACs)领域,它能够利用泛素-蛋白酶体系统在翻译后水平上调节蛋白浓度。HaloPROTAC3还与使用其他技术(比如RNAi和基因组编辑)的PROTAC介导的蛋白水平调节进行了比较。
HaloPROTAC 3也在活体内(小鼠)被用于降解肝脏中的PNPLA3。更多细节请参考Accumulation of PNPLA3 on lipid droplets is the basis of associated hepatic steatosis。