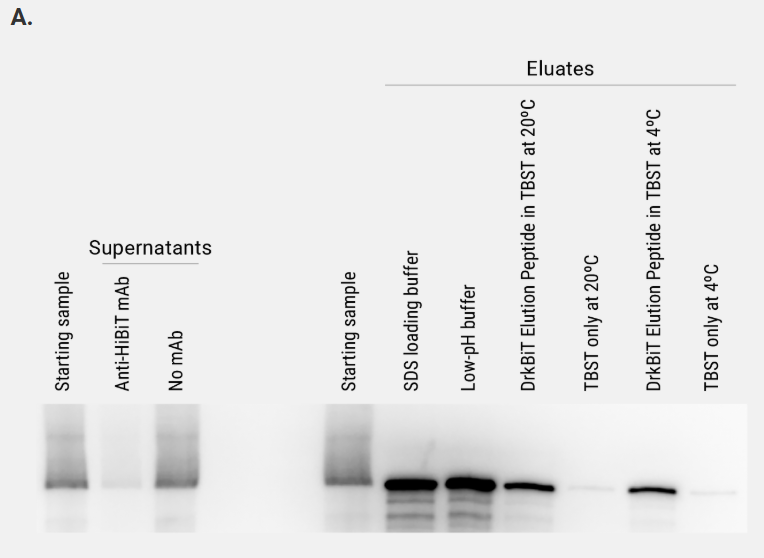
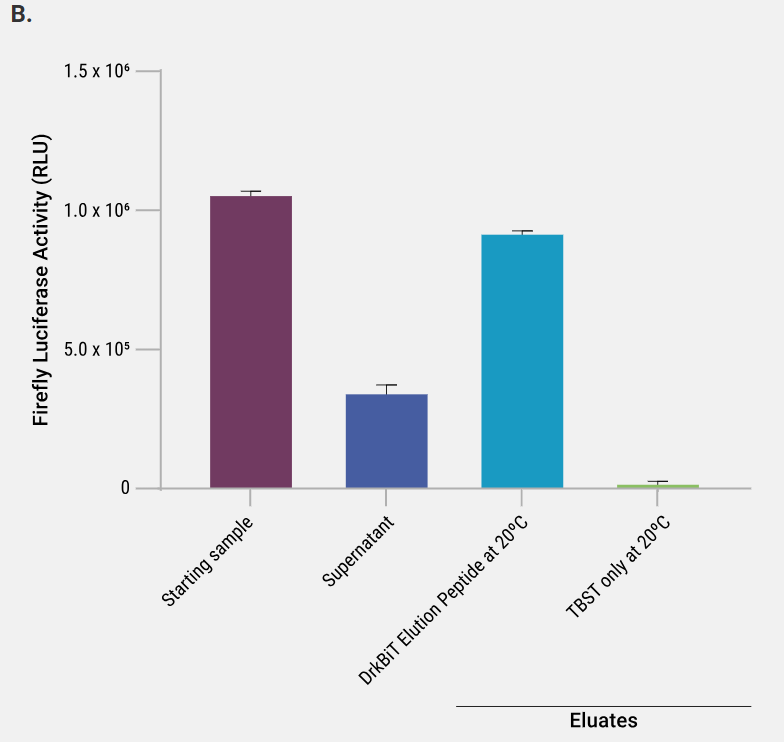
HEK293 细胞中HiBiT-标记的萤火虫萤光素酶免疫沉淀后不同洗脱策略的比较。起始样品为 5 ×10⁶ cells/ml 的裂解物,使用 Mammalian Lysis Buffer(Cat.# G9381)并补充 Protease Inhibitor Cocktail(Cat.# G6521)及 RQ1 RNase-Free DNase(Cat.# M6101)制备该细胞裂解物。澄清裂解液与磁珠于 4 °C 孵育 2 h。随后采用以下四种条件洗脱:1)SDS 上样缓冲液;2)低 pH 缓冲液;3)DrkBiT Elution Peptide(Cat.# N7400,用 TBST 稀释 100 倍)室温孵育 2 h;4)DrkBiT Elution Peptide 4 °C 过夜孵育。设置仅含TBST缓冲液的对照实验与DrkBiT洗脱肽洗脱效果进行比较。洗脱体积为起始裂解物体积的 1/4(100 µl vs 400 µl)。取等体积的起始裂解物、上清及洗脱液进行分析。图 A 采用 Nano-Glo® HiBiT Blotting System(Cat.# N2410)检测。左侧胶图低强度曝光,显示 Anti-HiBiT Magne® 磁珠可高效清除上清中的 Fluc-HiBiT,而无抗体对照磁珠则不能;右侧胶图高强度曝光,表明洗脱液中 Fluc-HiBiT 浓度显著高于起始样品。图 B 使用 ONE-Glo™ Assay(Cat.#E6110)测定萤火虫萤光素酶活性,证实采用 DrkBiT Elution Peptide 可在温和条件下洗脱并保留酶活性。
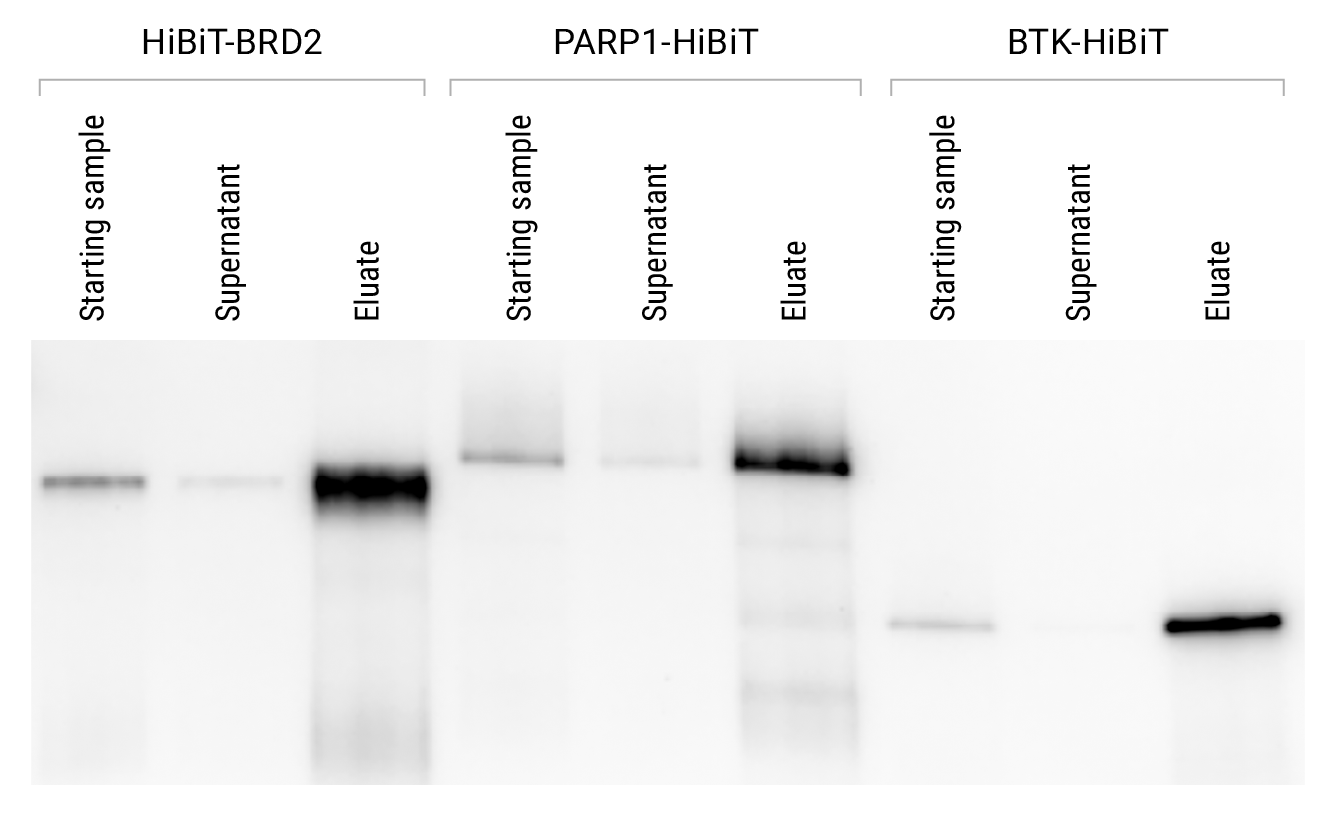
CRISPR 介导的 HiBiT 标记可在内源水平下对蛋白质进行免疫沉淀。利用 CRISPR/Cas9 基因组编辑技术,分别在 HEK293、DLD1 和 K562 细胞中将 HiBiT 标签添加至 BRD2、PARP1 和 BTK 的末端。按照技术手册 TM771 第 3.B 节的标准方案进行免疫沉淀。通过监测上清中蛋白的清除率以及洗脱液中蛋白的回收率来分析样品。将澄清的细胞裂解物起始样品(1 ml;5 × 10⁶ cells/ml)于 4 °C 过夜结合进行免疫沉淀,并以 80 µl 0.1 M 甘氨酸(pH 2.5)洗脱。洗脱液从磁珠上移除后,用 20 µl 2 M Tris(pH 7.5)中和。取等体积的各起始裂解物样品、上清液和洗脱液,使用 Nano-Glo®HiBiT Blotting 系统(Cat.# N2410)进行分析。
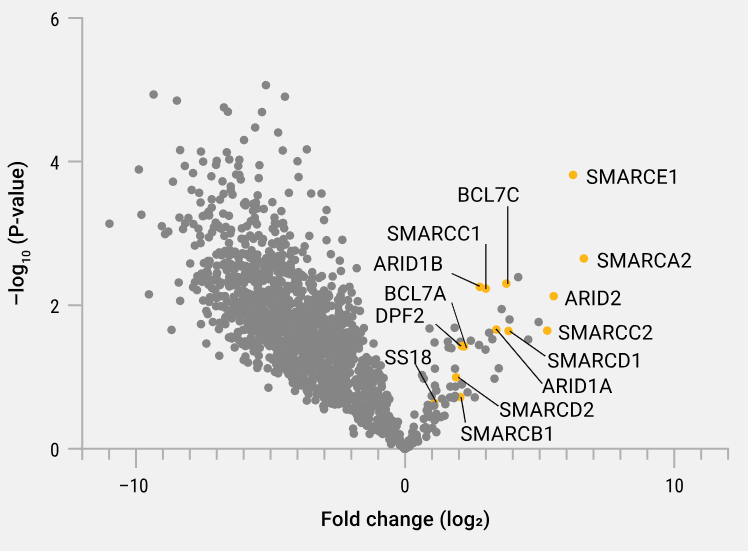
基于 HiBiT 的 IP-MS 鉴定 SMARCA2 相关 SWI/SNF 蛋白。利用 CRISPR/Cas9 基因组编辑技术,在 HeLa 细胞中将 HiBiT 标签插入内源 SMARCA2 的 C 末端。按照技术手册 TM771 第 3.B 节的标准方案,对编辑细胞和亲本细胞的裂解物分别进行三次重复免疫沉淀。洗脱液经 Magnetic Proteomics Sample Prep Kit(Cat.#CS3325A04)处理,并用 Trypsin/Lys-C(Cat.#V5071)酶解。肽段通过 Thermo Fisher Scientific Orbitrap Exploris 240 进行 LC-MS/MS 分析。数据使用 Proteome Discoverer 3.1 软件,以 Sequest 算法检索 Uniprot Human 数据库。火山图中的橘黄色圆圈标出了已知的 SMARCA2 相互作用蛋白,包括 SWI/SNF 染色质重塑复合体的成员。