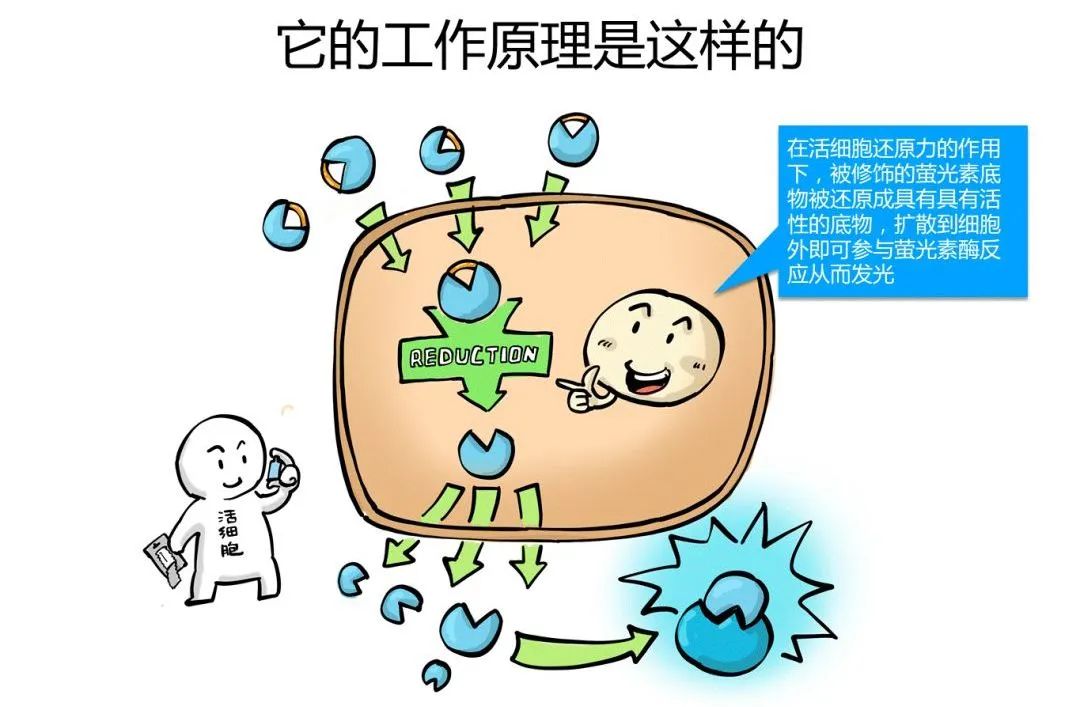
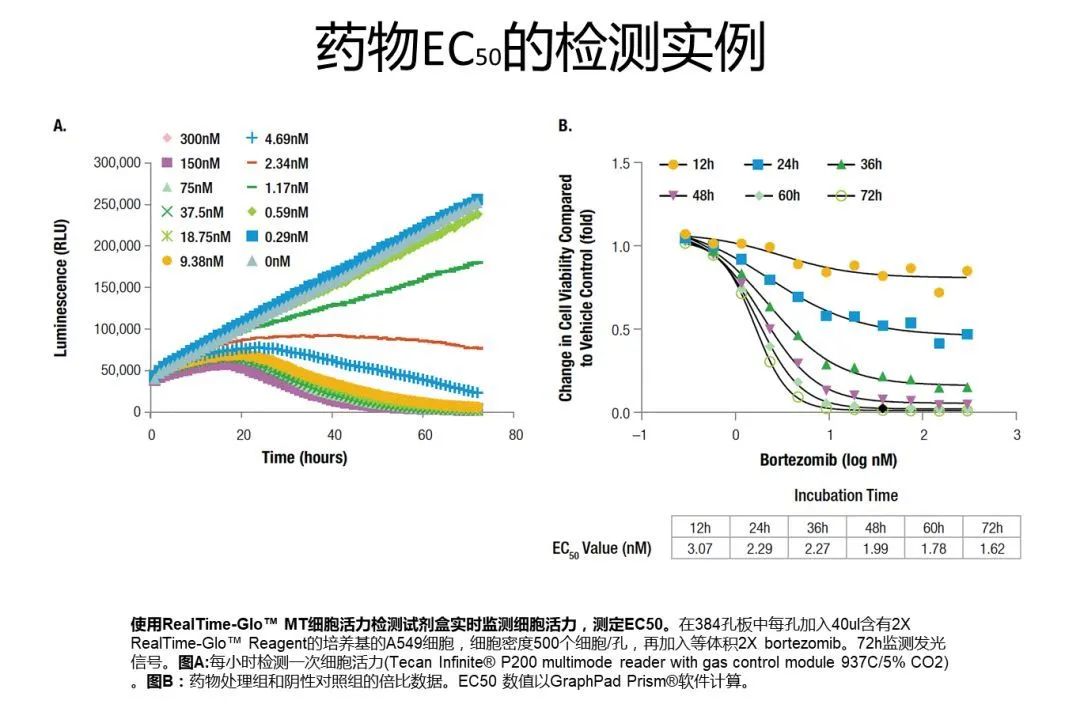
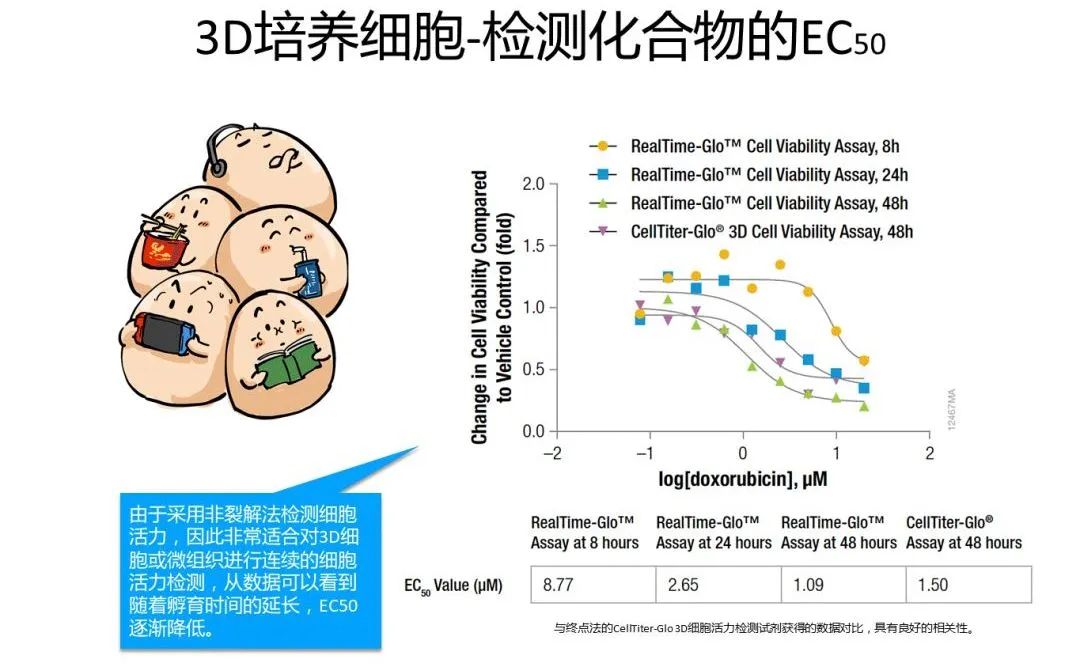
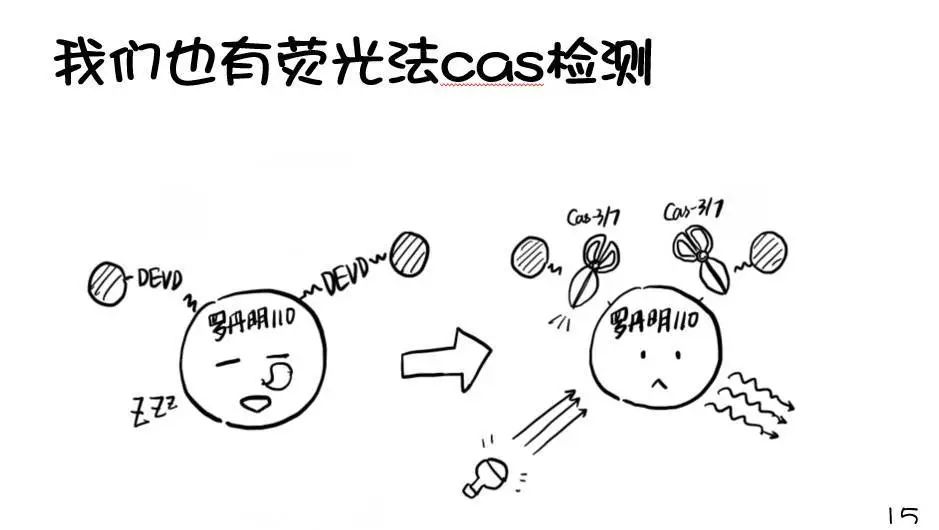
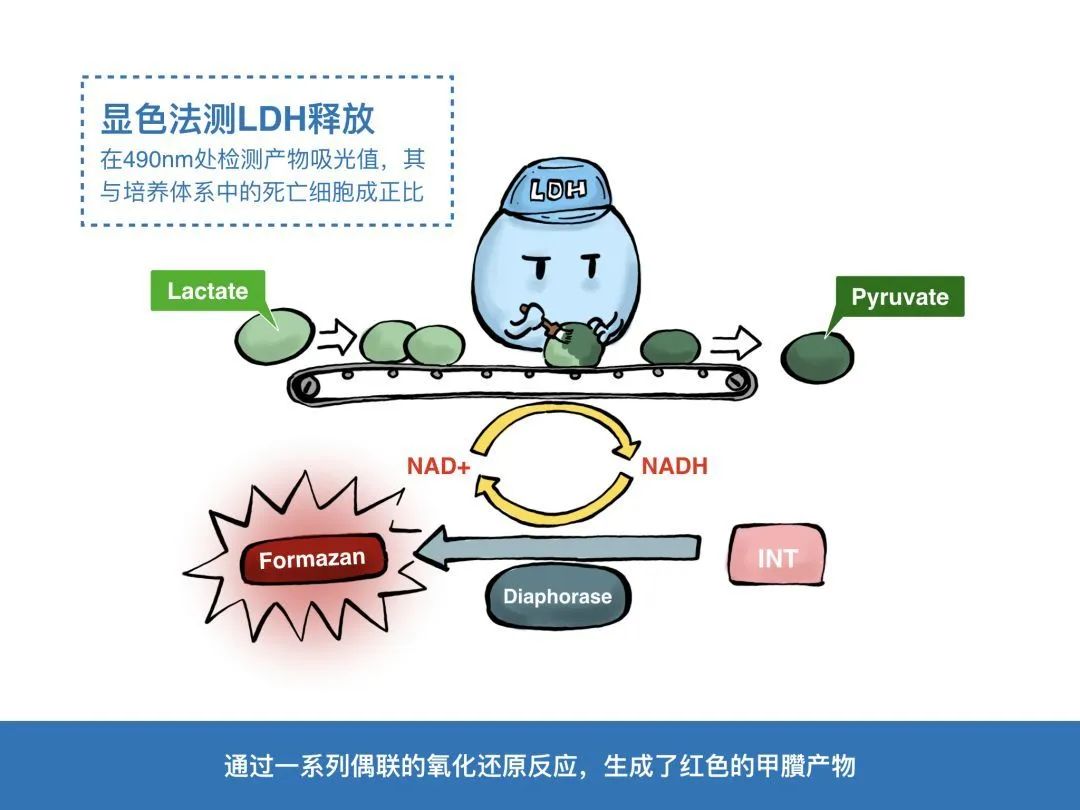
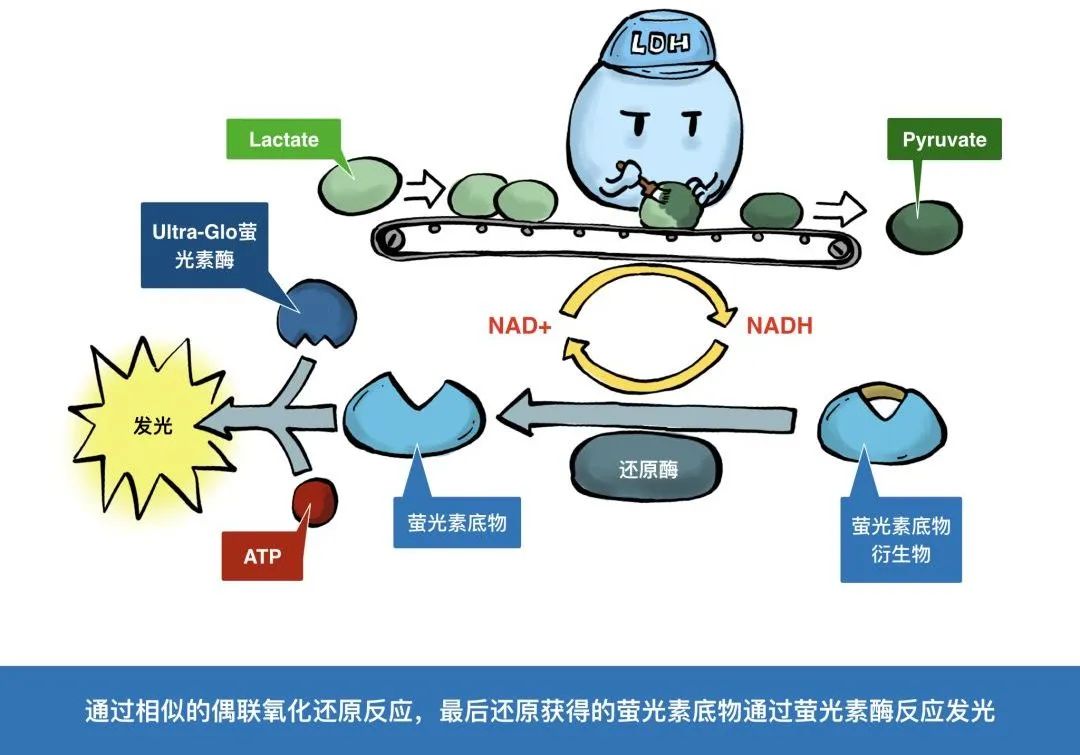
当细胞发生凋亡时,原本位于内侧的PS会向细胞膜外侧流动,从而出现在细胞膜外表面,这种现象称为PS外翻。这就为我们检测细胞凋亡提供了有用的靶标。为了检测外翻的PS,Annexin-V蛋白登上了舞台,成为最为经典的凋亡检测手段。下面就让我们跟随漫画小剧场学习一种实时的Annexin V凋亡检测法~
细胞膜结构:
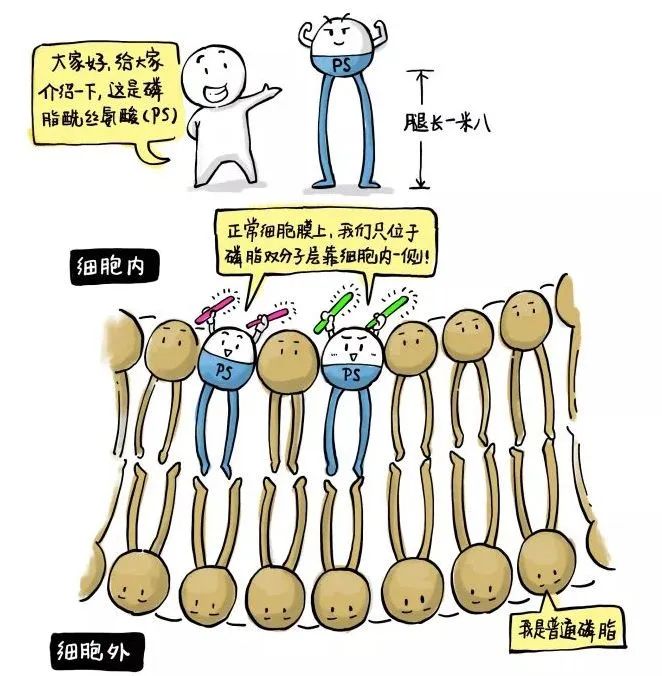
细胞膜是由磷脂双分子层构成的,其中有一种叫磷脂酰丝氨酸(PS),PS有个癖好,在健康的细胞膜上,PS只分布在靠近细胞质的膜表面。
PS外翻现象:
当细胞发生凋亡时,原本位于内侧的PS会向细胞膜外侧流动,从而出现在细胞膜外表面,这种现象称为PS外翻。随着凋亡进程的发展,这种外翻现象越来越严重。这就为我们检测细胞凋亡提供了有用的靶标。
Annexin-V和PS:好朋友,一辈子
为了检测外翻的PS,科学家找到了一种叫Annexin-V的蛋白,它不能够穿过细胞膜,但是能够特异性的结合磷脂酰丝氨酸,科学家在Annexin-V上绑定一个荧光基团,把这种带着荧光基团的Annexin-V加入到细胞培养体系中,一旦细胞发生凋亡,PS外翻,Annexin-V就会结合上去,洗掉没有结合的Annexin-V之后,就可以通过流式细胞仪或者荧光显微镜看到结合到细胞膜上的荧光基团了,荧光的强弱与凋亡程度呈现正相关。
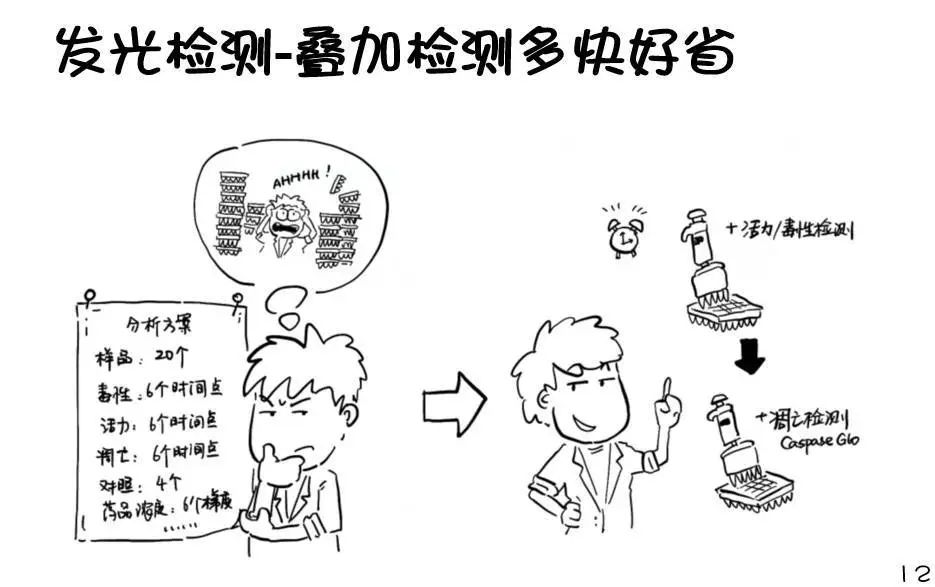
设置不同的药物浓度组:
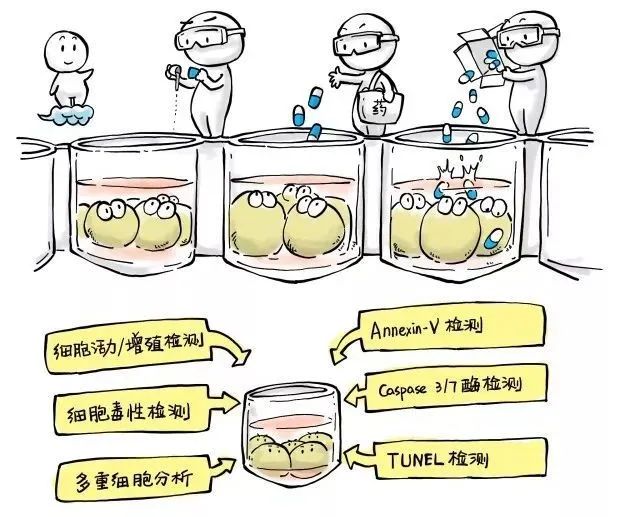
药物或者化合物对于细胞的影响,通常是与药物的浓度以及处理时间(exposure)相关,因此在相关的研究中,就要设置不同的药物浓度组。如果所需要的指标不能叠加检测,那么要为每一种指标都要设置一组样品。
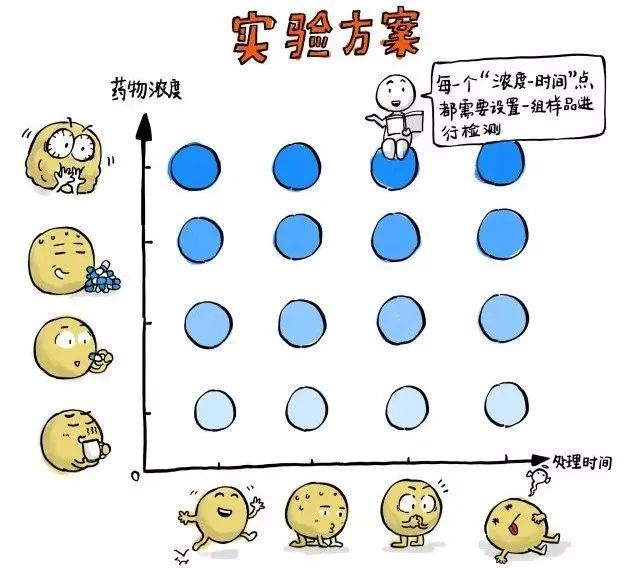
药物浓度-处理时间矩阵:
在传统的终点法检测中,样本一旦进入检测程序,就没法再进行继续培养了。因此除了设置几组不同的药物处理浓度外,对同一药物浓度,我们要为每个时间点都设置一组样本,这样就形成了一个 药物浓度-处理时间矩阵,矩阵上的每个点都需要使用终点法试剂进行检测!
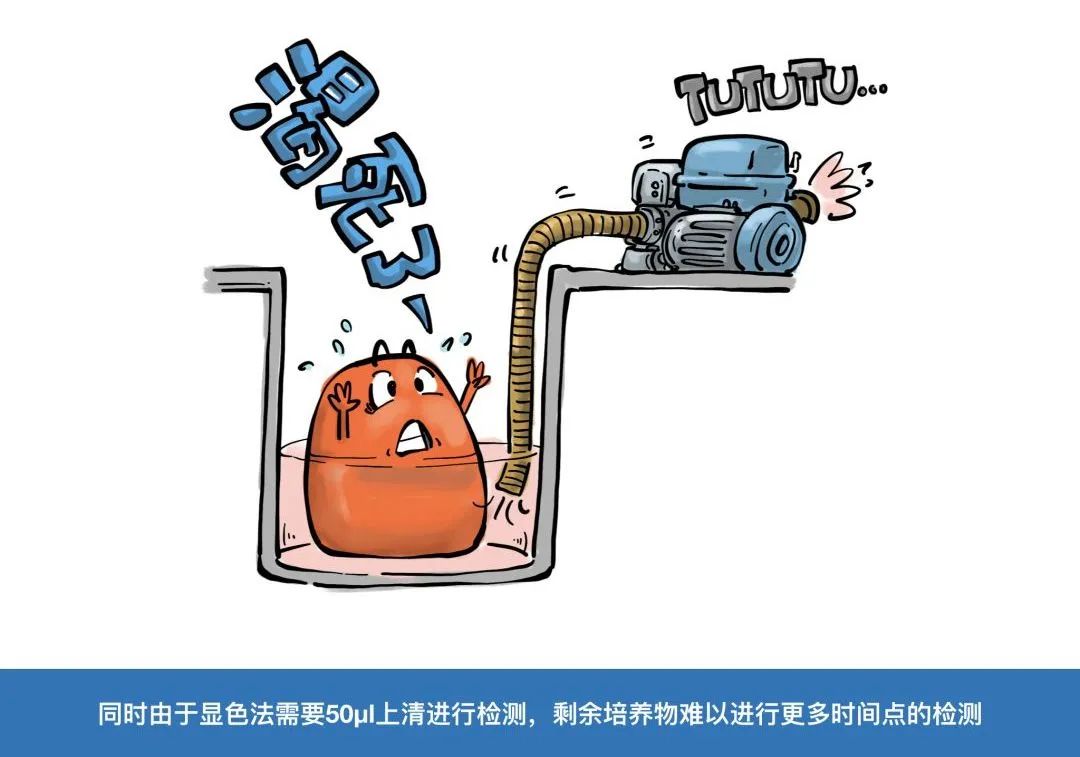
终点法之殇:
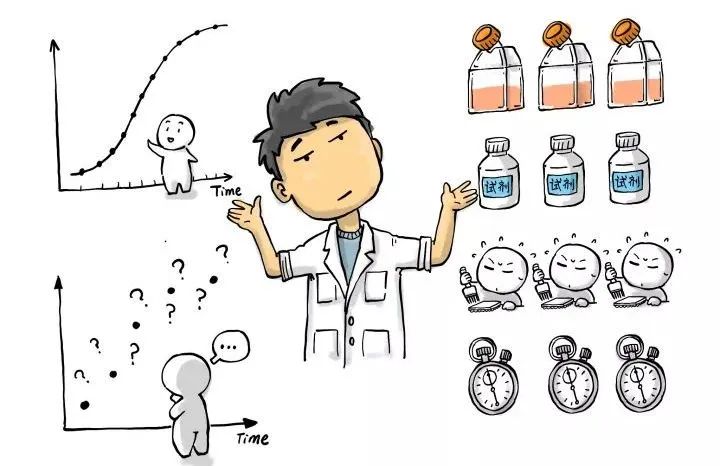
很显然,要精确描绘药物对细胞状态的影响,时间点的间隔应该越短越好(更接近连续检测的效果),但是检测时间点的增加,就意味着需要准备更多的样品、消耗更多的试剂,以及更多的实验操作人力。因此,很多时候只能在成本和效果之间做出妥协。
不能忽视的样本偏差:
在终点法研究药物处理时间对细胞影响时,还有一个不能回避的争议就是“样本偏差”。简单来说,多个样本在不同时间点测出来的数据,与同一个样本在不同时间点的真实状态是否相同?从理论上说,当然是用同一样本连续检测出来的结果更加接近真相,可惜在终点法检测中,样品一进入检测程序就再也没法回去重新孵育培养了。这是另一种妥协,也是Realtime真正的意义所在。
成本和效果之间的妥协:
最理想的结果当然是更短时间间隔的连续监控,要用终点法做到这个效果只能靠五字真言——“大力出奇迹”了。。。
解决实时检测的终极方案!
铺垫了这么多,接下来就是我们今天的主角闪亮登场啦!(此处应有疯狂打call)
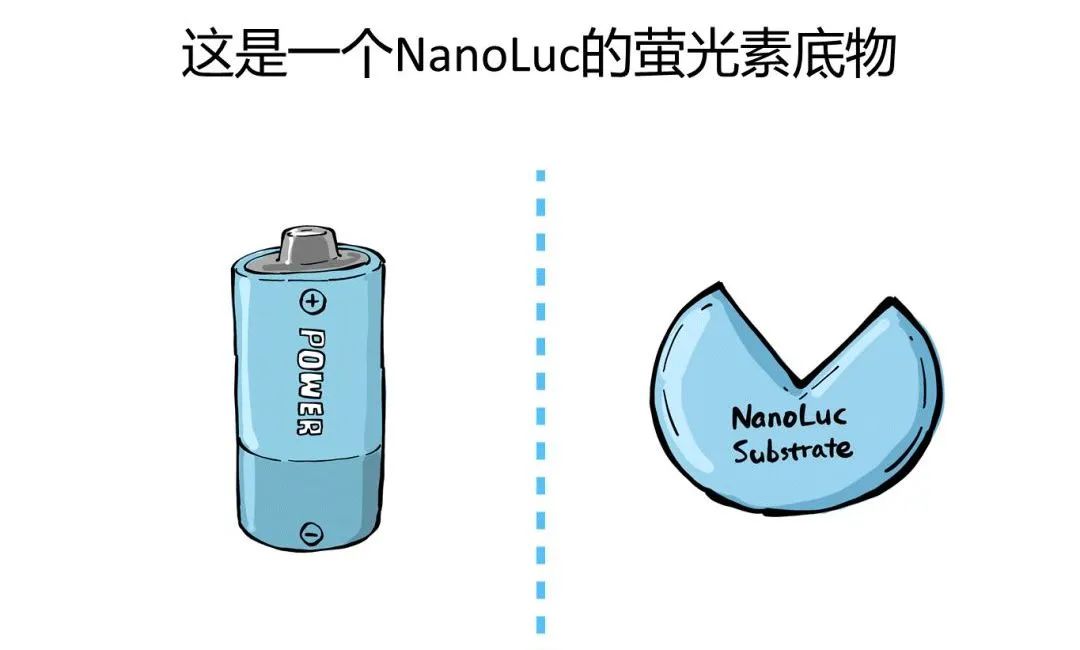
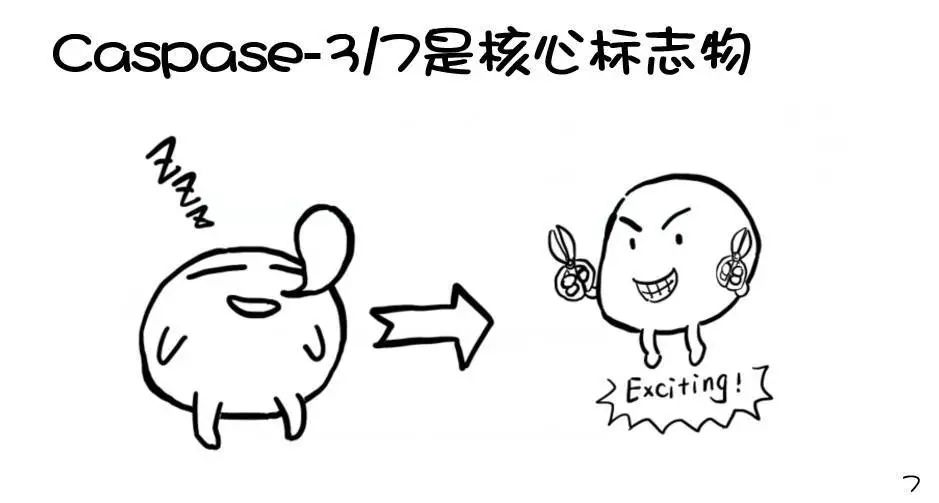
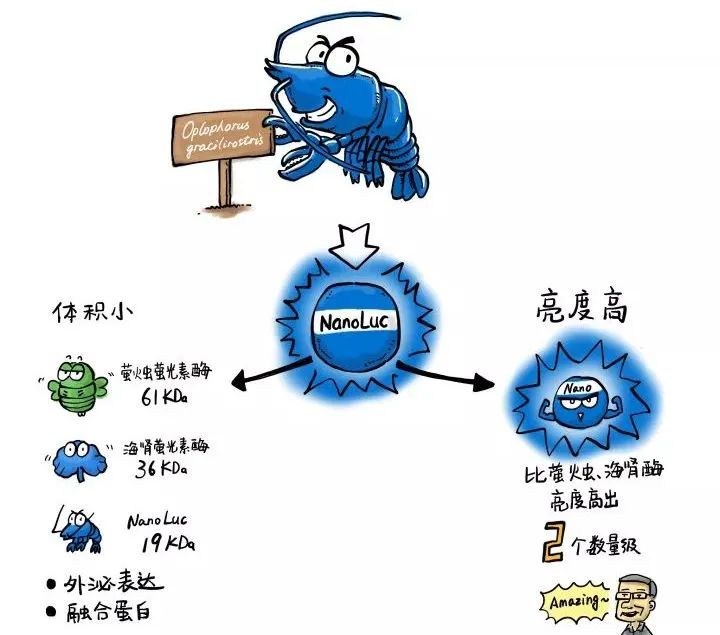
新一代的萤光素酶——NanoLuc
要说这个Realtime-Glo实时凋亡检测试剂盒,还得从promega新一代萤光素酶——NanoLuc说起。话说,在山滴那边海滴那边有一只小龙虾......好吧,它其实并不是龙虾,而是一种学名叫Oplophorus gracilirostris的虾......当然我也不知道叫什么鬼,反正就是一种虾,研究人员从它身上找到并发展了一种新型萤光素酶,就叫NanoLuc。
这种酶有两个牛b闪闪的特点:
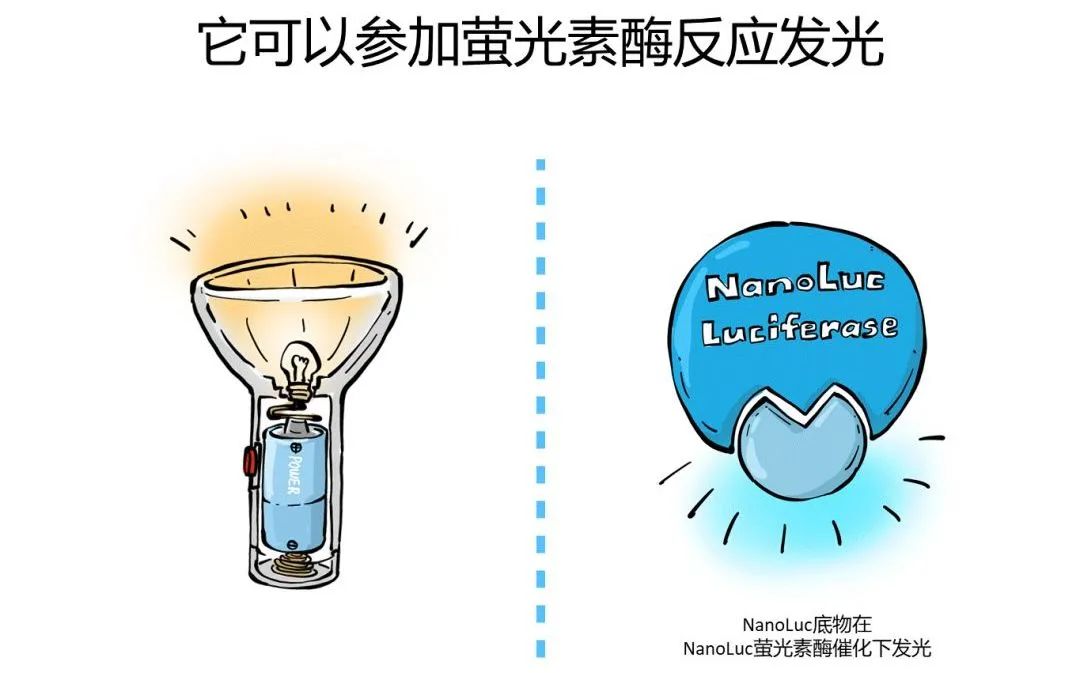
第一是:小:只有19KDa,可以很方便的和我们需要研究的蛋白融合在一起,不会过多影响到这个蛋白本身的功能。这个萤光素酶上加一个分泌标签就可以被细胞分泌到胞外培养体系中,这样我们做报告基因检测只需要提取一些培养基就可以了。
第二是:亮, 比萤火虫和海肾萤光素酶高了1-2个数量级。灵敏度更高,能够检测到更细微的变化趋势。
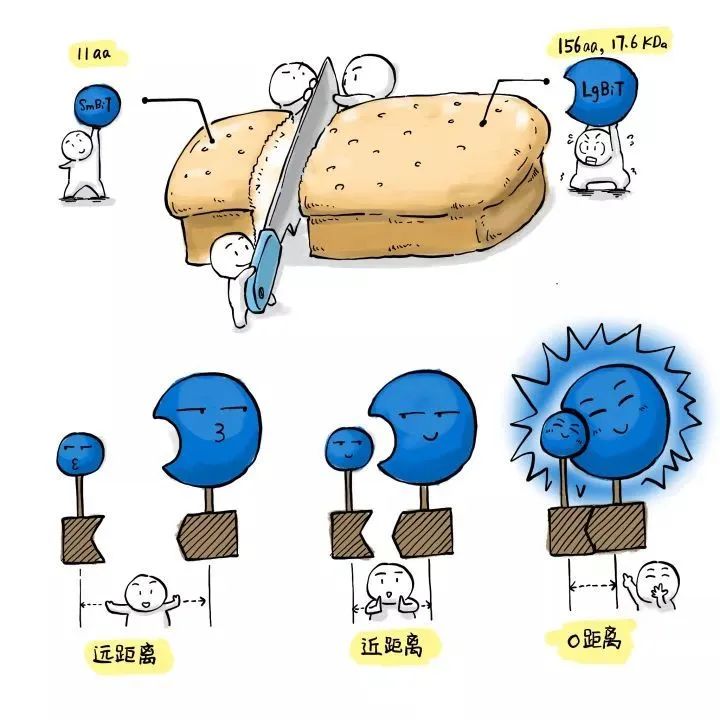
NanoLuc的进一步发展:NanoBiT
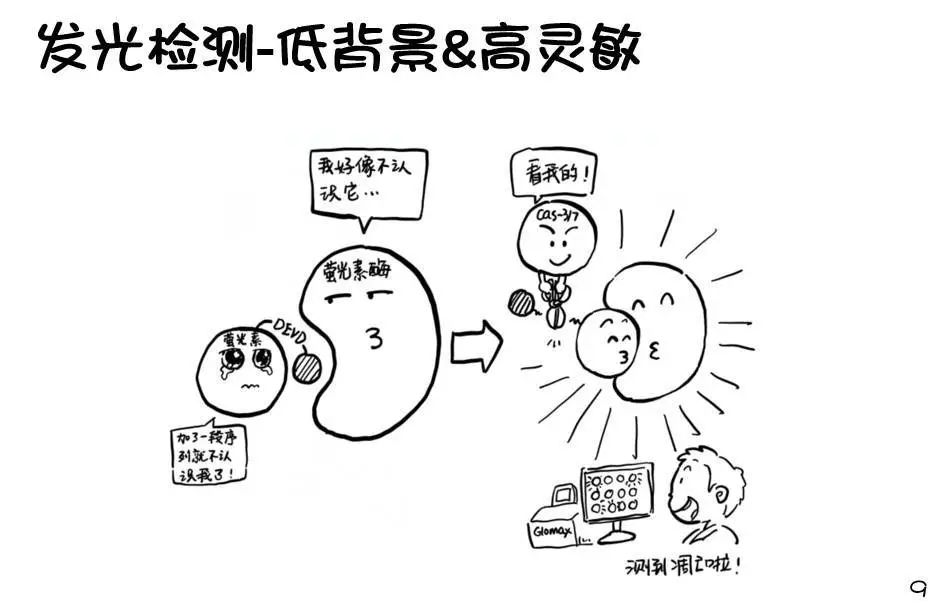
NanoBiT的全称是NanoLuc Binary Interaction Technology,它是NanoLuc萤光素酶的新玩法:研究人员将NanoLuc咔嚓一刀分成了两个亚基,一个11个氨基酸,一个156个氨基酸,分别称为SmBiT(small)和LgBiT(Large)。
这两个亚基在空间上足够接近时,就会重新“合体”成为具有萤光素酶活性的NanoLuc。因此发光的高低就可以反映二者在空间上的距离远近,这个特点使得NanoBiT技术在研究蛋白-蛋白相互作用时是非常有用。
NanoBiT+Annexin-V=实时PS外翻检测
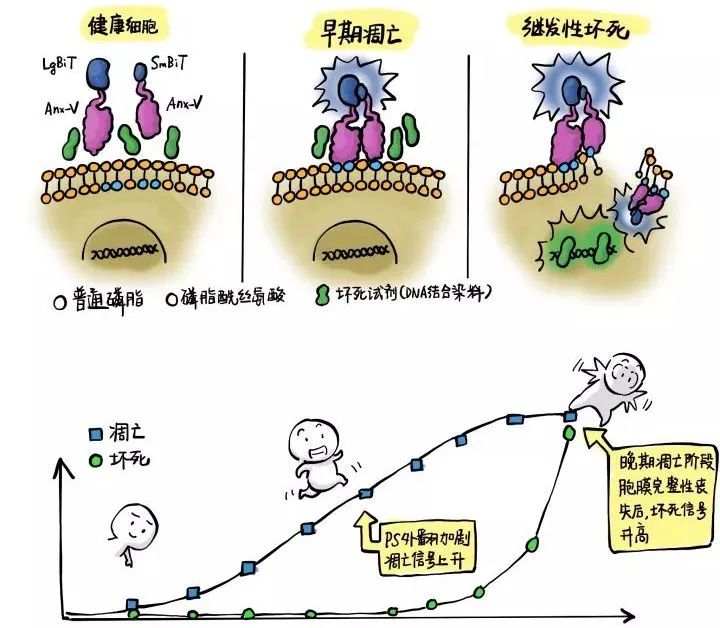
研究人员在Annexin-V上结合LgBiT或SmBiT,将它们以等摩尔比加入到细胞培养体系中,再加入萤光素酶反应所必须的底物以及Annexin-V与PS结合必须的钙离子。
健康细胞阶段:在健康细胞中,由于PS都在细胞膜内侧,细胞外的Annexin-V都处于游离状态,此时LgBiT和SmBiT距离很远,不产生萤光。
早期凋亡:当细胞被诱导发生凋亡时,部分PS外翻,在胞外等候已久的Annexin-V就会结合上去,此时Annexin-V身上连着的LgBiT和SmBiT就会在PS外翻处集中,互相靠近的两个亚基就有机会组成具有萤光素酶活性的NanoLuc,从而合作催化试剂中的底物发出萤光。
晚期凋亡-继发性坏死:当细胞凋亡进入晚期并发生继发性坏死时,细胞膜完整性破坏,Annexin-V会带着它的NanoBiT基团结合到细胞膜暴露出来的内部PS上,NanoBiT产生的萤光信号进一步上升。同时,原本不能穿过细胞膜的DNA结合染料就会进入细胞内,结合细胞内的DNA并表现出荧光活性。这个荧光信号表明细胞发生了坏死。
传统终点法 vs 实时检测法
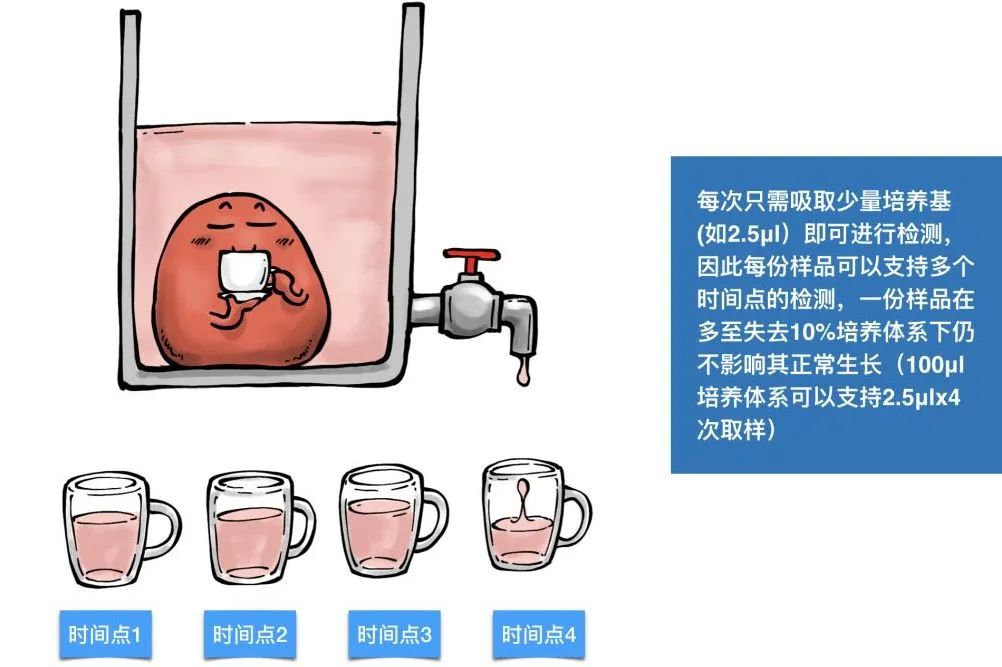
现在,我们将传统终点法和RealTime-Glo实时方法放在一起比较一下。在传统方法中,对于同一个药物浓度组,需要为每一个处理时间点都准备出一组样品,并在设计好的时间点进行“去除培养基-加试剂-孵育-检测”等操作。而对于RealTime-Glo实时凋亡检测来说,由于加入的Annexin-V-NanoBiT检测试剂不会对细胞正常生长产生影响,因此可以和药物同步加入进行处理,随后任何时间点均可以进行检测,真正摆脱了时间点的限制,这就是“一份样品,打通全场”。
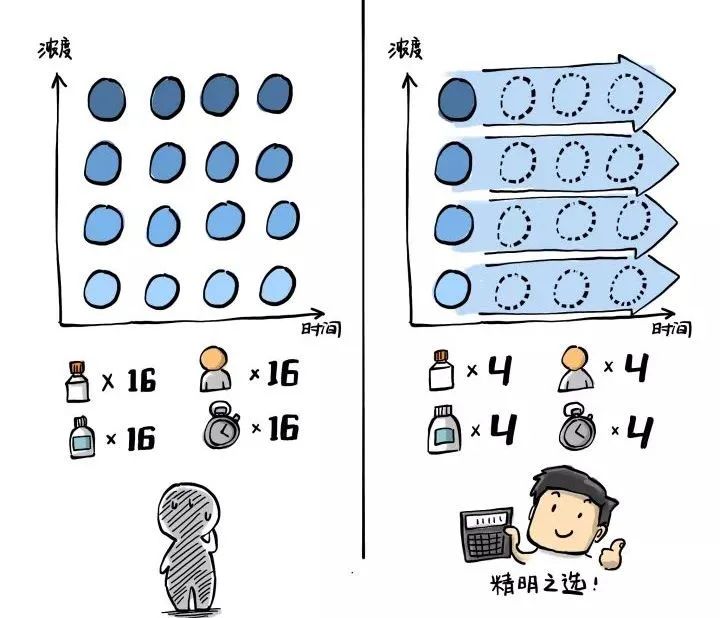
传统终点法 vs 实时检测法
为了更好的说明实时检测的巨大优势,我们再将传统终点法中需要的“浓度-时间”矩阵拿出来和RealTime-Glo实时检测方案对比一下。我们可以看到在下图用于举例的4x4(四个浓度x四个时间点)的矩阵中,实时法在试剂消耗、人员和操作时间、样品准备上都有显著的优势。
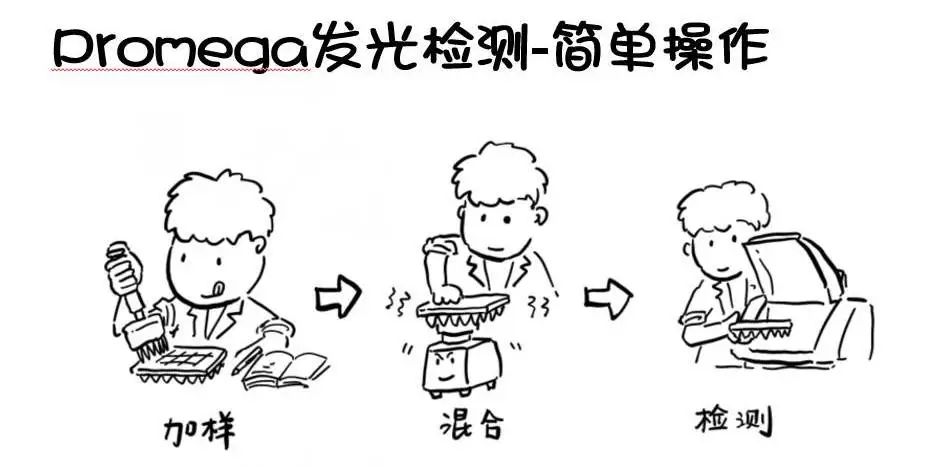
不能更简单的操作:
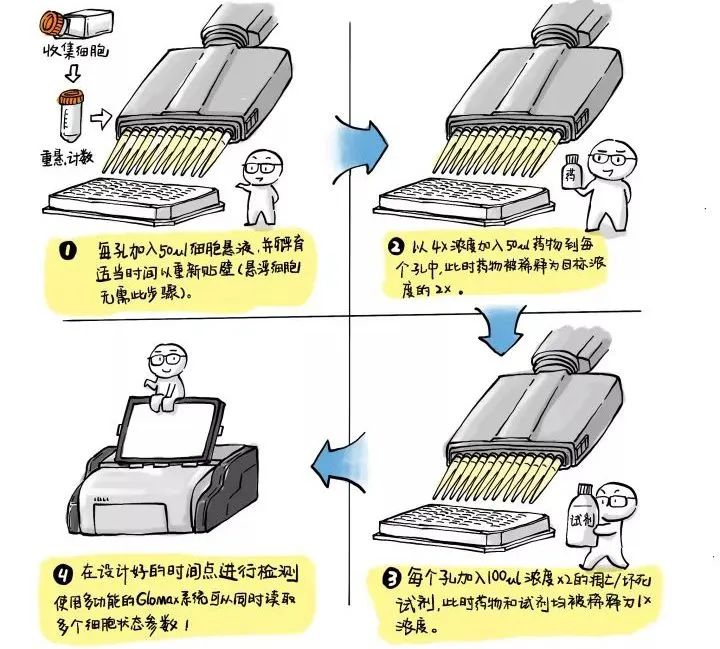
秉承了Promega对于一步法操作的执着,RealTime-Glo的操作也是非常简单的。以200μl的96孔板体系为例:
第一步:铺细胞。和其他细胞分析方法一样,我们先收集细胞、重悬 、计数并在96孔板中种入合适密度的细胞50μl。如果是贴壁细胞就需要一定的时间重新贴壁,如果是悬浮细胞就不必了。
第二步:加药。以最终药物浓度的4倍加入50μl药物。
第三步:加试剂。加入100μl的RealTime-Glo Annexin-V试剂到相应的孔中(试剂中含有Annexin-V-SmBiT、Annexin-V-LgBiT、额外的钙离子、萤光素酶反应底物、检测坏死的DNA荧光染料)。
第四步:孵育检测。在需要检测的时间点即可读数获得当前的凋亡/坏死状态数据。
对化合物毒性机理的探讨:
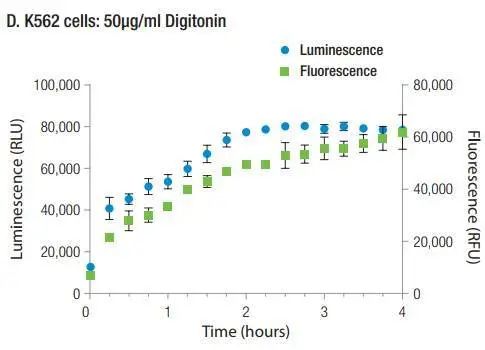
从PS外翻发生到出现膜损伤,有个8.5h的延迟,这说明该种化合物在当前浓度下,其对细胞的毒性效应是通过先诱导细胞的凋亡,然后再引起继发性坏死。
该药物处理细胞后,PS外翻和细胞膜损伤同时出现并升高,这说明此种药物处理下的PS外翻并非指示凋亡,而是由于直接毒性作用导致的细胞膜崩坏所致。
RealTime-Glo Annexin-V:
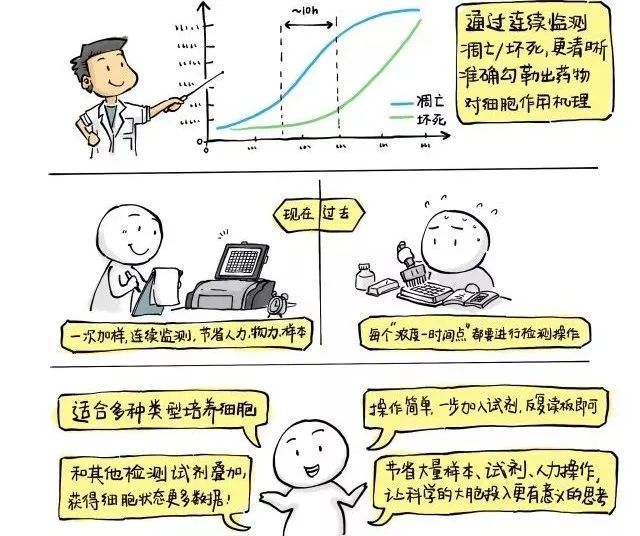
多:快好省测凋亡多:获得的数据多。在RealTime-Glo Annexin-V 凋亡&坏死检测试剂盒中,通过比较凋亡曲线和坏死曲线之间的延迟(图中的10h),就可以发现该药物在该浓度下从引起凋亡到诱导继发性坏死之间的所需时间。还能够和别的细胞分析试剂进行叠加 ,获得更多关于活力、毒性方面的数据。
快:操作快,一步法加入-混合-孵育即可读数检测,节省人力和时间。
好:基于萤光素酶检测的机理,灵敏度高,背景低,能够检测到非常微小的细胞凋亡状态变化,且方便和别的荧光方法进行叠加。
省:连续实时检测,节省试剂、样本、人力和时间。
两款产品可供选择:
RealTime-Glo Annexin-V Apoptosis & Necrosis Assay
货号:JA1011(100次),JA1012(1000次)既提供了检测凋亡的Annexin-V,也提供了同步检测细胞膜完整性的DNA染料。
RealTime-Glo Annexin-V Apoptosis Assay
货号:JA1000(100次),JA1001(1000次)只提供了检测凋亡的Annexin-V,可以自行叠加其他的试剂进行分析。
细胞凋亡检测重要资源大放送:
点击此处了下载最新细胞凋亡检测法介绍手册
凋亡相关知识介绍,请点击此处浏览