NanoLuc如何推进病毒学研究?
萤光素酶是构建重组报告病毒的重要工具,重组报告病毒可用于在动物模型中进一步了解病毒的生命周期和致死性。尽管萤光素酶的使用面临一些挑战,但是带有嵌入式报告基因的病毒使得利用生物发光成像追踪同一动物体内随时间推移的感染情况变得更加容易。

使用NanoLuc®萤光素酶意味着可产生一种接近天然的、可复制的报告基因甲型流感病毒。但是由于以下几个原因,生成流感报告基因病毒其实是很难的:
1. 所有病毒基因在体内都必不可少,排除了用报告基因进行简单的基因置换的可能性。
2. 紧凑的基因组无法耐受大片段插入,这种大片段插入会随着时间的推移而失去稳定性并丢失。
3. 片段插入可能会严重削弱复制。
4. 在编码区末端的插入可能会破坏病毒包装。


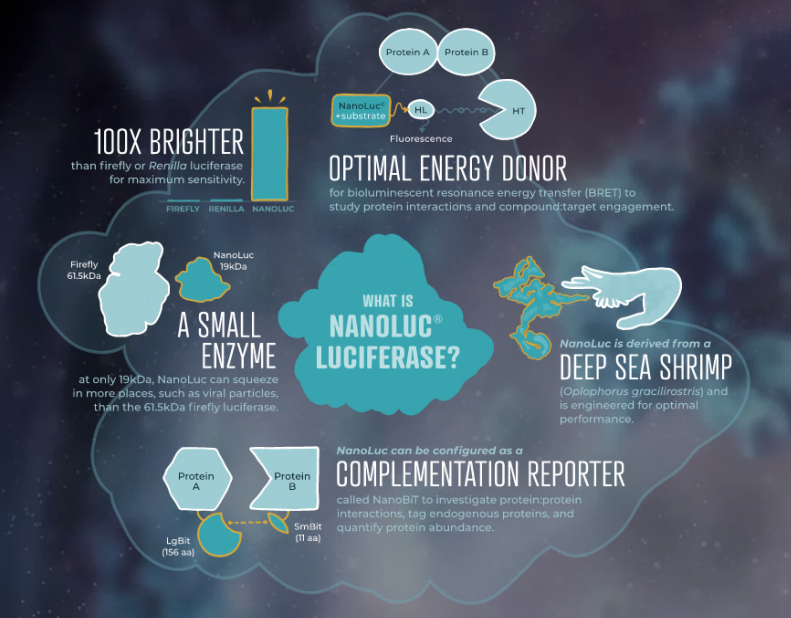
FLuc最常用于动物活体成像,因为FLuc在活体动物中的发射波长约为600nm,这更适合于深层组织成像。FLuc约为61kDa,是一种相当大的蛋白质,而病毒衣壳大小的限制意味着许多病毒基因组不能整合额外的1,600多个核苷酸的DNA。病毒对34kDa RLuc报告基因的耐受性更强些,但由于它发射的蓝光很容易在动物体内散射而使成像很困难。尽管在动物模型中对NLuc的蓝光进行成像确实是一个挑战,但Nluc信号的亮度和较长的寿命及其小尺寸都是显著的优势。Gaussia萤光素酶也是一种小而明亮的酶,但由于它从细胞中分泌并且是快速闪光型信号,因此难以用于体内(in vivo)工作。
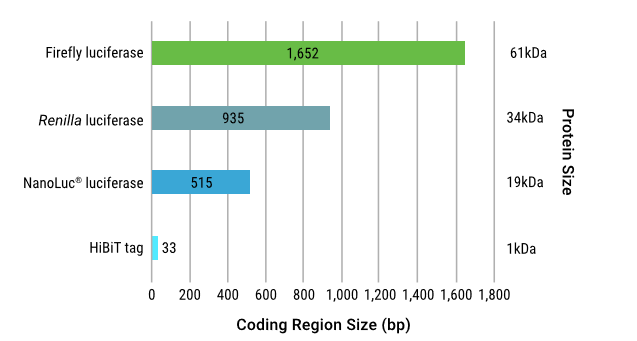
图1.萤火虫(FLuc)、海肾(RLuc)和NanoLuc®(NLuc)萤光素酶与HiBiT生物发光蛋白标签的编码区大小的比较。萤光素酶的大小(以千道尔顿(kDa)为单位)列在了图中各相应条形的右侧。



重组报告基因病毒是在动物模型中研究病毒致病性和传播的重要工具。而近来使用NanoLuc®和NanoBiT®技术进行体内病毒生命周期的研究也备受科研工作者们的关注。

2012年,我们引入了一种新型报告酶——NanoLuc®萤光素酶(NLuc)及其检测试剂——Nano-Glo® Luciferase Assay System。NLuc是通过分子方法从一种19kDa的深海虾萤光素酶演化而来,这种分子演化提高了酶的稳定性并改善了亮度。原始萤光素酶的天然底物——腔肠素,通过化学方法演变成一种更亮、更稳定的底物——furimazine。
NLuc和furimazine一起产生的发光信号比萤火虫萤光素酶(FLuc)或海肾萤光素酶(RLuc)亮100倍以上。
其额外的好处是,NanoLuc®发光信号的寿命很长,表现出辉光动力学,而非像其他小而亮的萤光素酶(如Gaussia萤光素酶)那样产生快速闪光信号。此外,NLuc的其他一些关键特性使其成为理想的报告基因。这种小的19kDa酶具有热稳定性,在很宽的pH范围内都具有活性,并且不需要翻译后修饰或翻译后成熟来形成有活性的酶。NLuc产生蓝光,最大发射波长为460nm。如需了解更多信息,请参阅Hall等人的文章中关于NLuc和Nano-Glo® Assay System的创建、表征和早期应用的细节(浏览至文末可查看参考文献详情)。




NanoLuc®萤光素酶如何克服挑战
流感报告基因病毒可实现在活体动物(而非细胞培养模型)中实时分析感染过程,这对于确定新出现的流感病毒的致病性和传播潜力非常重要。
Tran等人通过使用小而亮的NLuc和巧妙的重组病毒设计方法克服了这些挑战。已知聚合酶亚基基因PA可耐受在C末端的插入,因此被选为整合位点。尽管PA-NLuc融合被认为与野生型PA一样具有活性,但所选择的病毒构建体还是使用了来自猪捷申病毒(porcine teschovirus)的自切割2A肽作为连接肽(最终产生单独的PA和NLuc蛋白),以避免其他PA功能(如运输和组装)可能带来的任何问题。
重组NLuc病毒在培养物中和体内(in vivo)以接近天然的特性复制。用利巴韦林(ribavirin)的处理证明,来自NLuc的发光是由于基因表达引起,而非NLuc的偶然携带或包装。基于细胞的检测比较了空斑形成单位与发光之间的关系,发现二者具有很好的相关性(r2=0.99),与48-72小时的空斑检测相比,NLuc检测仅需要8小时,这是Nluc检测的优势。
NLuc病毒在小鼠中表现出致病性和致死性,与亲本病毒没有区别。将该病毒用于体内成像,并追踪病毒载量和感染扩散到小鼠肺部的情况。结果显示,一种已知限制甲型流感病毒株向禽类复制的突变可产生与NLuc病毒相同的表型。因此,这种报告基因病毒可用于评价新出现的病毒以及在动物模型中评估抗病毒药。该实验室的后续研究还展示了一种不同的表达NLuc的H1N1甲型流感病毒在白鼬模型中的接触和空气传播情况。
NanoLuc®萤光素酶的整合可产生稳定的复制型报告基因甲病毒
虽然用于在体外(in vitro)和动物体内追踪病毒复制的报告基因甲病毒确实存在,但插入FLuc报告基因存在几个缺点,即:
1. 转基因快速丢失的可能性。
2. 复制减弱。
Sun等人试图通过选择不同的整合位点和使用NLuc来解决这些问题。先前的工作将报告基因融合到非结构蛋白3(nsP3)保守性较差的羧基端一半。Sun等人将辛德比斯(Sindbis)、基孔肯雅(Chikungunya)以及东方和委内瑞拉马脑炎病毒中的上述位点作为靶点,将FLuc(61kDa;1,650个核苷酸)或NLuc(19kDa;513个核苷酸)与之融合。同时还对其他位点和策略进行了检验。将衣壳蛋白和PE2蛋白之间的插入位点用于FLuc和NLuc,其中包含Trosea asigna病毒(TaV)肽2A序列,以构建不发生蛋白融合的报告基因。此外,还构建了由亚基因组启动子驱动的表达NLuc或FLuc的重组病毒,该启动子不与任何病毒蛋白融合,但仍然是病毒基因组的一部分(浏览至文末可查看参考文献详情)。
无论使用哪种插入方法,带有FLuc的插入片段都会快速丢失,这可以通过细胞传代过程中发光减弱和Western blot显示表达蛋白丢失来判断。NLuc构建体非常稳定。与单独的nsP3基因相比,nsP3融合表现出较低的表达,无论是与FLuc还是NLuc融合。致死性研究证实,TaV-NLuc构建体与亲本病毒一样致命。动物模型成像证实,表达NLuc的病毒在体内(in vivo)复制并在整个动物体内扩散,而由于重复复制后FLuc插入片段的丢失,表达FLuc的病毒的发光局限于注射部位。



前面讲述了两个有关NLuc借助其小身材而产生更好、更稳定的重组病毒的例子。有关在同行评审的出版物中引用含NLuc的病毒或病毒样颗粒的详细列表,请点击以下按钮。
目前,我们已推出了一个短的11个氨基酸的生物发光蛋白标签,该标签利用结构互补来形成有功能的萤光素酶,也可以应用于病毒研究。



2016年,我们引入了一种蛋白质结构互补技术,称为NanoLuc Binary Technology
(NanoBiT ®)。初期的同行评审论文集中于如何将NLuc在第156和第157个氨基酸之间分开,以产生一个156aa亚基和一个13aa亚基。
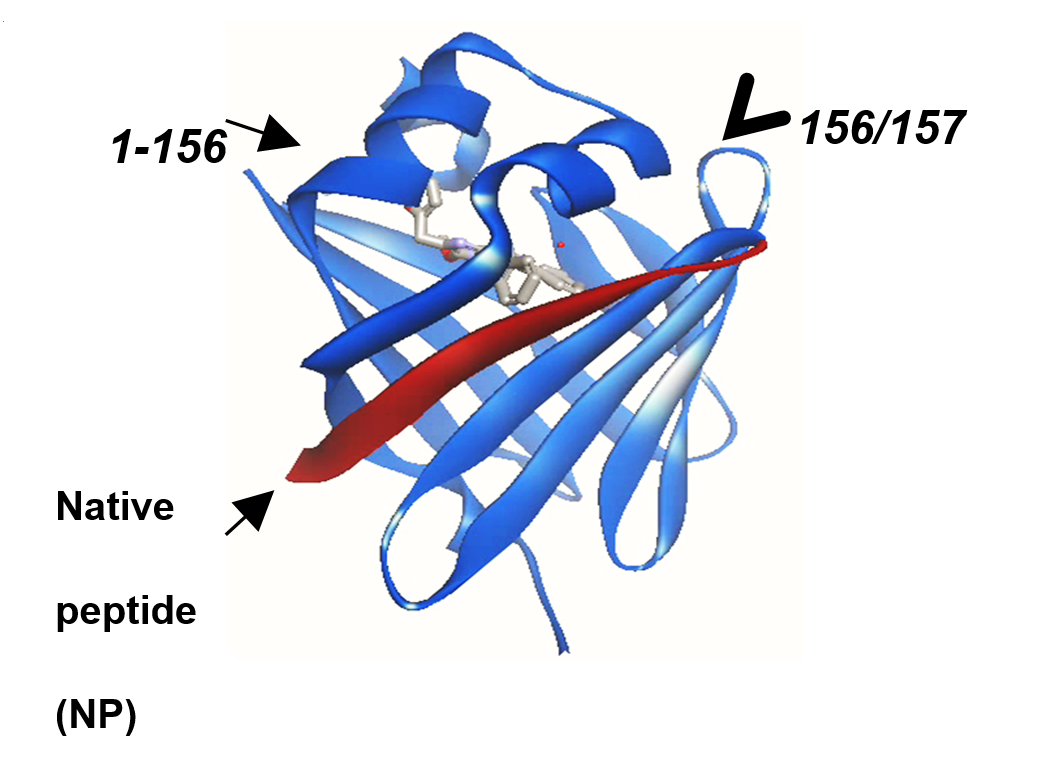
较大的亚基通过分子方法进行演化,以提高稳定性和表达水平,从而产生LgBiT亚基(18kDa)
另一部分为1.3KDa的肽段。在对小肽段研究过程中,发现不同序列的1.3KDa肽段对于LgBiT的亲和力存在差别。
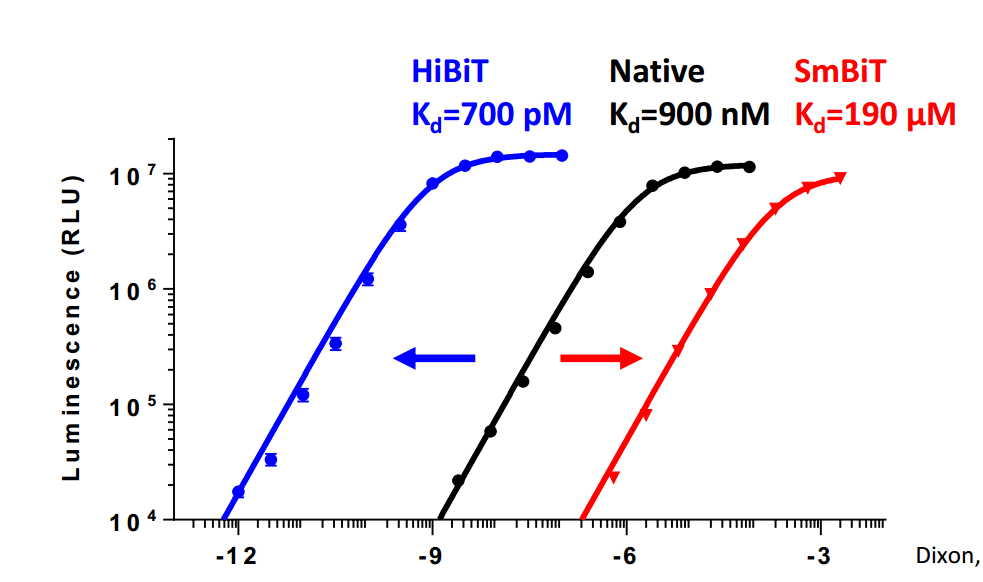
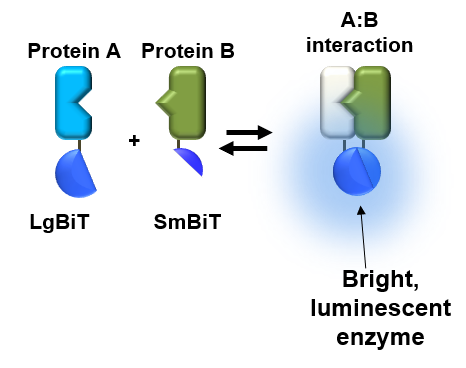
LgBiT本身几乎没有固有的酶活性。我们在体外制备了350多种13aa亚基的肽变异体,并测试其与LgBiT的结合特性和与LgBiT的结构互补性,以产生新的有功能的酶(NanoBiT®萤光素酶)。两种肽脱颖而出:一种对LgBiT具有极低的亲和力,称为SmBiT;另一种对LgBiT具有极高的亲和力,称为HiBiT。
LgBiT和SmBiT亚基用于检测蛋白-蛋白相互作用,其中所研究的蛋白质的亲和力使LgBiT和SmBiT足够接近从而可相互作用。这种蛋白-蛋白相互作用的分子内研究是使用NanoBiT® Protein:Protein Interaction System进行的。
HiBiT蛋白标签检测系统
HiBiT可以自发地与LgBiT互补,形成一种几乎与NLuc一样明亮的NanoBiT®萤光素酶。Schwinn等人的研究检验了HiBiT亚基作为生物发光蛋白标签的效用。HiBiT标签(11个氨基酸)可以被附加到蛋白质上,并且这种融合可以通过含有LgBiT亚基和furimazine底物的试剂识别。有三种针对HiBiT标签蛋白的检测试剂可供选择:Nano-Glo® HiBiT Lytic Detection System(Nano-Glo® HiBiT裂解型检测系统)和Nano-Glo® HiBiT Extracellular Detection System(Nano-Glo® HiBiT胞外检测系统),以及一种用于在Western blot上检测HiBiT标签蛋白的独特试剂——Nano-Glo® HiBiT Blotting System(Nano-Glo® HiBiT印迹系统)。
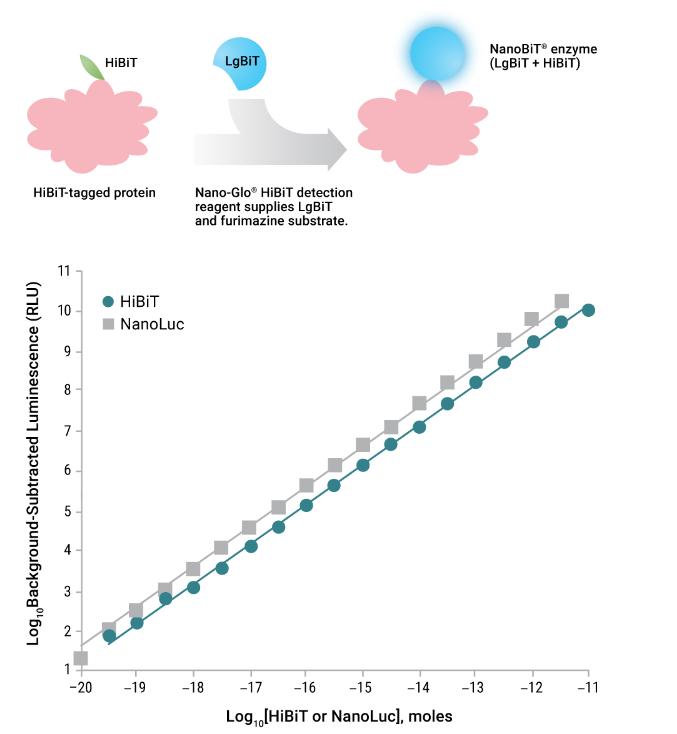
图2.使用Nano-Glo® Detection System检测HiBiT的示意图(顶部)。HiBiT/LgBiT NanoBiT®萤光素酶产生的发光信号的线性度(底部)。图中显示了由全长重组NanoLuc®萤光素酶或与饱和LgBiT孵育的HaloTag®-HiBiT产生的发光信号。
正如NLuc因其小“身材”而加速了病毒学研究一样,HiBiT的效应看起来很有前景。不像NLuc那样与169aa(约500个核苷酸)的报告基因竞争,现在只需要插入一个11aa(33个核苷酸)的小片段就足够了。关于如何将HiBiT标签用于病毒学研究的早期例子已经发表。
HiBiT标签简化了对西尼罗病毒(West Nile Virus)进入和释放的研究
诸如西尼罗病毒之类的黄病毒(flavivirus)通常需要生物防护设施来进行常规病毒学工作。对病毒附着于靶细胞和病毒颗粒释放的研究不需要病毒的全基因组。只需要为细胞提供含有结构蛋白的质粒,就可以使病毒样颗粒从内质网出芽并从细胞中分泌出来。这些亚病毒颗粒(SVP)可用于研究病毒与细胞的附着,而不需要生物防护设施。

Sasaki等人开发了一种系统来寻找西尼罗病毒侵入的抑制剂。这些实验依赖于基于ELISA的检测来定量病毒颗粒的数量。在最佳条件下,检测至少需要2小时,且定量范围有限(约2倍)。将HiBiT整合到E蛋白的SVP内环,并用于制备HiBiT-亚病毒颗粒(SVP-HiBiT)。将含有病毒M蛋白和HiBiT-E蛋白的质粒转染到293T细胞中,并使用Nano-Glo® HiBiT Extracellular Detection System监测48小时内培养基样品中HiBiT-SVP的出现。Nano-Glo® HiBiT Assay只需10分钟即可完成,并显示出较大的线性定量范围(约5倍)。使用Nano-Glo® HiBiT Blotting System,通过蛋白质印迹法证实了HiBiT序列的存在。对Rab11 G蛋白进行的siRNA敲低(knockdown)大大减少了常规西尼罗SVP的分泌,同样也抑制了HiBiT-SVP的释放(浏览至文末可查看参考文献详情)。
加入包含E和M蛋白的西尼罗病毒衣壳蛋白,以及带有包装序列的亚基因组RNA的构建体,可产生西尼罗病毒病毒样颗粒(VLP)。这些VLP可以将基因传递到靶细胞进行表达。此外,VLP可用来研究细胞附着,亚基因组RNA可以包含一个报告基因以用于证明病毒内化。将HiBiT序列添加到衣壳蛋白的C末端,并使用稳定表达LgBiT蛋白的Vero细胞株监测VLP-HiBiT的附着和内化。使用Nano-Glo® Live Cell Assay System监测VLP-HiBiT内化时发生的NanoBiT®酶形成。用NLuc-VLP来证明如何用该系统来筛选病毒侵入的抑制剂——在该文的情况下,是针对西尼罗病毒E蛋白的抗体或者网格蛋白包被的小窝形成(clathrin-coated pit formation)的抑制剂。
HiBiT标签可产生接近天然复制的更好的报告基因黄病毒(flavivirus)
报告基因病毒有助于确定病毒的生命周期和发现所需的宿主细胞蛋白。Puig-Basagoiti等人借助一种重组NLuc丙型肝炎病毒(HCV)确定了宿主载脂蛋白E在病毒分泌中的重要性。该实验室担心包含全长NLuc的病毒在复制上存在差异。因此,研究人员测试了HiBiT标签以获得更好的复制动力学。该实验室制备了带HiBiT标签的HCV、登革热(DENV)、日本脑炎(JEV)和牛病毒性腹泻(BVDV)病毒,并回收了稳定的HiBiT报告基因病毒,其复制效果更好,明显高于含有全长报告基因的病毒。
在稳定表达LgBiT的细胞中或使用Nano-Glo® HiBiT Lytic Detection Reagent进行体外研究,以确定重组病毒的传染性和复制率。HiBiT-HCV能够证实载脂蛋白E对病毒分泌的重要性。HiBiT-JEV可在多种宿主细胞中复制,包括仓鼠(BHK21)、人(HeLa、A549、Huh7)、猴(Vero E6)和蚊子(C6/36)。HiBiT-DENV仅在人和蚊子细胞中进行了测试,结果表明可以复制。使用BVDV时,HiBiT与包膜蛋白融合,该实验室担心HiBiT融合会改变病毒颗粒的形成。但是,发现该融合与野生型病毒相比并未产生影响。
对所有四种HiBiT病毒进行了针对已知黄病毒抑制剂的敏感性测试,其表现均与亲本病毒相似。使用HiBiT-HCV和HiBiT-JEV来筛选一组69种蛋白酶抑制剂,并使用萤光素酶读数(而非病毒滴度)来鉴定抑制性化合物。此筛选不仅确认了已知的HCV抑制剂,并且发现了一种对HiBiT-JEV有效的化合物,该化合物对HiBiT-DENV也有效。HiBiT-HCV在人肝嵌合小鼠模型中复制,并对HCV抑制剂治疗有反应。
在稳定表达LgBiT的细胞中或使用Nano-Glo® HiBiT Lytic Detection Reagent进行体外研究,以确定重组病毒的传染性和复制率。HiBiT-HCV能够证实载脂蛋白E对病毒分泌的重要性。HiBiT-JEV可在多种宿主细胞中复制,包括仓鼠(BHK21)、人(HeLa、A549、Huh7)、猴(Vero E6)和蚊子(C6/36)。HiBiT-DENV仅在人和蚊子细胞中进行了测试,结果表明可以复制。使用BVDV时,HiBiT与包膜蛋白融合,该实验室担心HiBiT融合会改变病毒颗粒的形成。但是,发现该融合与野生型病毒相比并未产生影响。
对所有四种HiBiT病毒进行了针对已知黄病毒抑制剂的敏感性测试,其表现均与亲本病毒相似。使用HiBiT-HCV和HiBiT-JEV来筛选一组69种蛋白酶抑制剂,并使用萤光素酶读数(而非病毒滴度)来鉴定抑制性化合物。此筛选不仅确认了已知的HCV抑制剂,并且发现了一种对HiBiT-JEV有效的化合物,该化合物对HiBiT-DENV也有效。HiBiT-HCV在人肝嵌合小鼠模型中复制,并对HCV抑制剂治疗有反应(浏览至文末可查看参考文献详情)。


如前所述,NanoBiT®蛋白质:蛋白质相互作用(PPI)分析是建立在LgBiT亚基和称为SmBiT(6)的低亲和作用肽之间的相互作用与LgBiT 和SmBiT不会自发地产生相互作用,但如果两者足够靠近产生互补,便成为研究PPI的理想伴侣。像这一对, HiBiT:LgBiT,也可形成明亮的NanoBiT®荧光素酶。
Sekiba等人使用NanoBiT®检测在HEK 293和HepG2细胞中寻找乙型肝炎病毒蛋白HBx与宿主蛋白DDB1相互作用的抑制剂。该方法用于筛选一批800+ FDA批准的化合物,并鉴定出了5个化合物对蛋白互作有40%的抑制作用。选用最强的抑制剂硝唑尼特(nitazoxanide)进行进一步研究。
Rawle等人正在寻找包括病毒和宿主蛋白在内的HIV-1逆转录复合物的抑制剂。研究的重点是破坏病毒p66:宿主eEF1A与抑制剂的相互作用,其中该抑制剂是与p66结合而不是与eEF1A结合。在HEK 293T细胞中设计了NanoBiT® PPI实验,以筛选> 1200 scaffold的>40%的破坏作用,同时维持>70%的细胞存活率。鉴定了9种候选化合物进行进一步的研究。另外,Rawle等也利用寨卡病毒NS2B和NS3蛋白构建了NanoBiT®PPI阳性对照对。
卡波氏肉瘤相关疱疹病毒(KSHV),也被称为人类疱疹病毒8,已被证实与人类的几种癌症有关。KSHV潜伏期相关核抗原(LANA)是建立KSHV潜伏感染的关键。LANA的一个重要部分是宿主SUMO2相互作用结构域。Ding等人从基于植物药物的天然产物中寻找LANA-SUMO2相互作用的小分子干扰物。在HEK 293细胞中设计了NanoBiT®检测。从一种热带常青树中鉴定出一种强有力且有效的抑制剂。在细胞模型中,抑制剂阻断了原发感染和病毒潜伏期(浏览至文末可查看参考文献详情)。
NanoBRET™蛋白:蛋白
相互作用测定
生物发光共振能量转移(BRET)是一种常用的监测蛋白:蛋白相互作用的技术。在BRET中,如果萤光素酶和荧光受体相互靠近(<10nm),能量就会从萤光素酶转移到荧光受体上。许多BRET系统是使用基于RLuc的供体和荧光蛋白作为受体。在NanoBRET™检测中,明亮的NLuc作为供体,受体是与自标记HaloTag®蛋白共价结合的荧光染料。
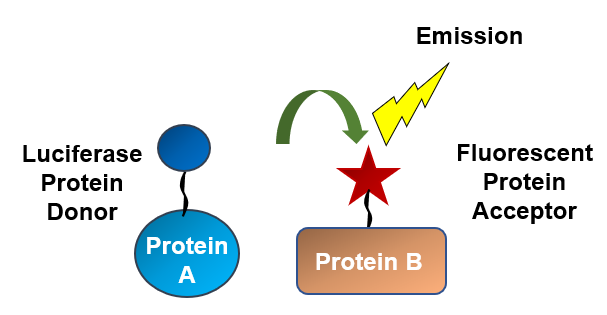
Nishi等发现乙肝病毒核心蛋白(HBc)与宿主蛋白Pin1的相互作用是病毒发病机制的关键。这种相互作用需要HBc的磷酸化。为了了解是否存在可能破坏这种相互作用的磷酸酶,本次实验在HEK 293细胞中使用NanoBRET™检测,分别研究NLuc - HBc与带有HaloTag®(HT)蛋白标签的150种人类磷酸酶的相互作用。筛选选出了两种磷酸酶,其中一个是丙酮酸脱氢酶磷酸酶催化亚基,它确实可以使HBc去磷酸化。
Miyakawa等人指出,HIV-2病毒蛋白X (Vpx)与宿主蛋白SMHD1的相互作用使HIV-2感染在不发生细胞分裂的细胞中发生。SMHD1能够水解所有细胞的dNTPs,这使得在一个不发生细胞分裂的细胞中进行复制变得困难。SMHD1与Vpx的相互作用导致泛素连接酶多聚泛素化,并通过蛋白酶体降解导致SMHD1的降解。Vpx是已知的一种磷酸化蛋白。研究发现Vpx磷酸化在SMHD1相互作用中是必要的。
一项对412种激酶的体外研究发现了50种激酶可以使Vpx磷酸化。使用NLuc - Vpx和每个HT -激酶分别在HEK293细胞中检测这些候选激酶的相互作用。三个激酶显示出了强的NanoBRET™信号,其中两个是PIM激酶家族的成员。之后对PIM1、2和3进行了进一步的研究。有趣的是,NanoBRET™实验表明,缺乏PIM磷酸化的丝氨酸的突变体Vpx严重破坏了与SMHD1的相互作用,但保留了与泛素连接酶的一个组分的相互作用(浏览至文末可查看参考文献详情)。

NLuc是一种小而明亮的萤光素酶,对许多感兴趣的病毒的基因组大小影响最小,这使其成为重要的病毒学研究工具。
病毒研究对于了解病毒性疾病如何出现和传播是必不可少的。重组报告基因病毒有助于研究者揭示病毒的内部运作机制。然而,病毒已经进化出最小的基因组来感染、复制和传播,因而不能很好地耐受额外的基因组负担。NLuc是一种小而明亮的萤光素酶,由于对许多靶病毒的基因组大小产生的影响极小,因此成为一种重要的研究工具。HiBiT生物发光蛋白标签进一步降低了重组报告基因病毒必须携带的负荷,并且当在检测中与其LgBiT结合伴侣配对时,能够提供接近NLuc的发光信号。



普洛麦格(北京)生物技术有限公司
Promega(Beijing)Biotech Co.,Ltd
地址:北京市东城区北三环东路36号环球贸易中心B座907-909
电话:010-58256268
技术支持邮箱:chinatechserv@promega.com