
质谱级胰蛋白酶的常见缺点
及解决方法
生物治疗蛋白高精度肽图分析用胰蛋白酶的开发
1. 引言
在蛋白质谱领域中,胰蛋白酶最受欢迎,这是因为胰蛋白酶性能极佳、蛋白中胰蛋白酶裂解位点分布最佳且所得肽段带强电荷。但是,现有质谱级胰蛋白酶常常无法提供所需的性能。我们发现,这些胰蛋白酶具有非特异性裂解活性,若大量使用,非特异性裂解活性尤为显著。蛋白消化期间自体水解和蛋白水解活性不足所致的蛋白水解抗性位点消化不完全也属于胰蛋白酶的常见缺点。此外,这些胰蛋白酶易受动物源性蛋白污染,且批间活性变异性显著。本文介绍了可解决这些缺点的新胰蛋白酶。新胰蛋白酶尤其适用于生物治疗蛋白的表征。
新胰蛋白酶优势:
Promega开发了新胰蛋白酶,并解决了现有质谱级胰蛋白酶的缺点。
● 新胰蛋白酶不具有常见于MS级胰蛋白酶中的非特异性裂解活性。
● 与现有MS级胰蛋白酶抗性相比,经新型化学修饰方法修饰后,新胰蛋白酶的自体水解抗性显著提高。
● 新胰蛋白酶的蛋白水解效率有所改善。新胰蛋白酶可有效裂解蛋白水解抗性位点。
● 新胰蛋白酶的纯度高且批间性能再现性佳。新胰蛋白酶不含动物源性的污染性蛋白。
2. MS级胰蛋白酶的特点
01
MS级胰蛋白酶的非特异性裂解活性
● MS级胰蛋白酶的非特异性蛋白水解活性:
增加胰蛋白酶:Ab比例并过夜消化帕尼单抗抗体,然后进行RP-HPLC-UV(Agilent 1200)分析。
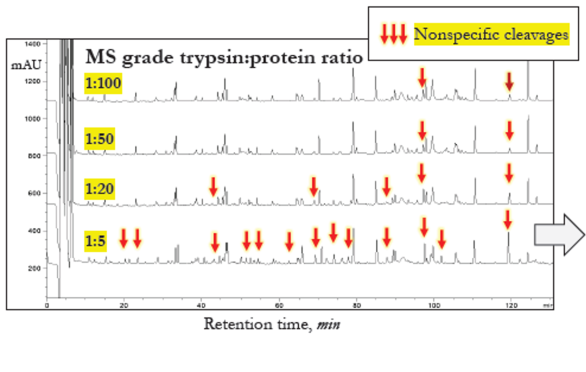
● 质谱级胰蛋白酶消化物中的非特异性裂解:

质谱级胰蛋白酶中胰凝乳蛋白酶样裂解活性较低但可检测到。
若反应中使用大量胰蛋白酶,则此活性显著变大。
02
MS级胰蛋白酶的自体水解、中等蛋白水解效率和批间变异性
● MS级胰蛋白酶的自体水解:

MS级胰蛋白酶经化学修饰后可抑制自体水解。但是,自体水解仍较为显著。
● 消化效率:
消化后抗体的RP-HPLC-UV分析(1:10胰蛋白酶:蛋白比,o/n)

MS级胰蛋白酶的蛋白水解效率中等。即便胰蛋白酶与蛋白的比例为1:10,蛋白水解抗性位点的消化也不完全。
● 批间变异性:
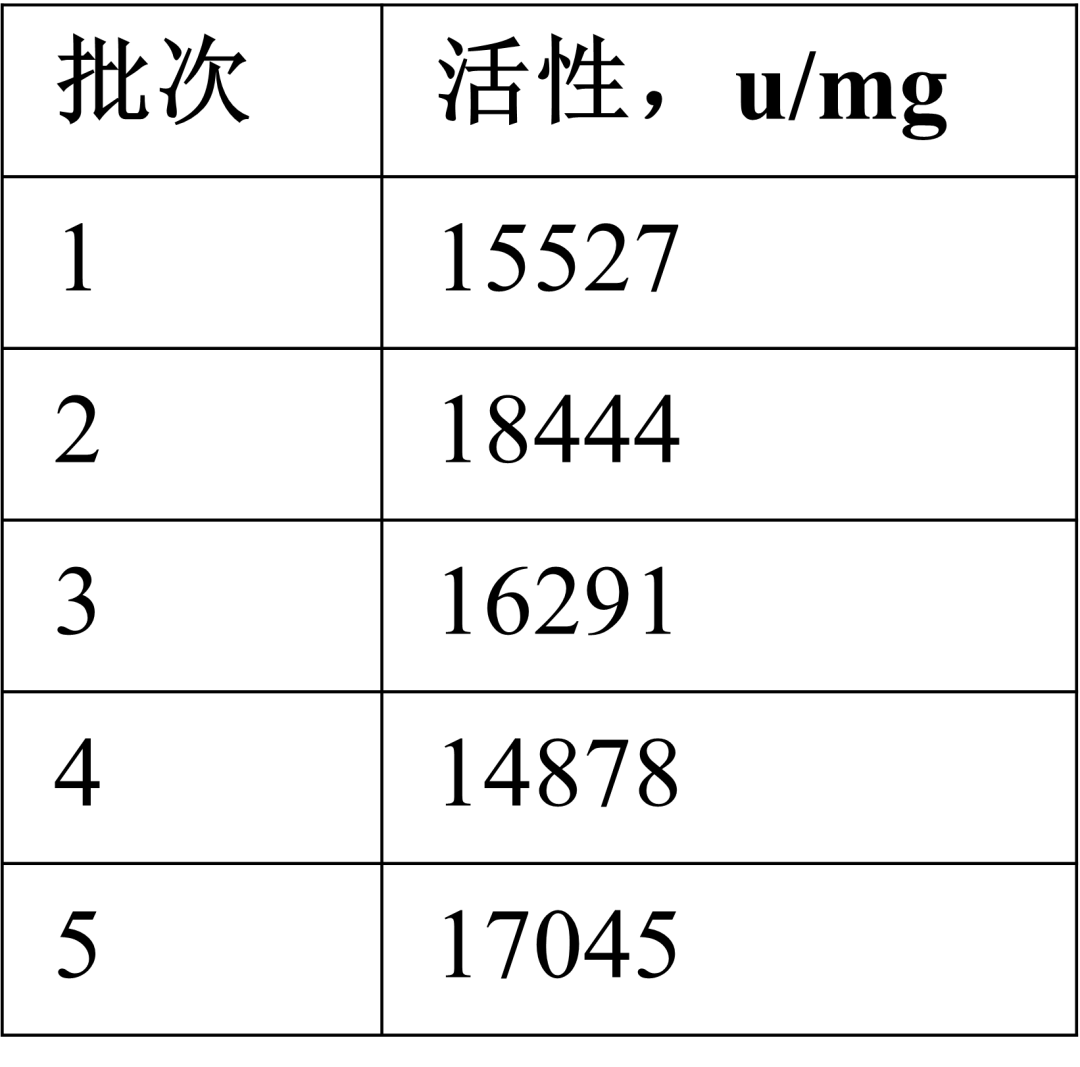
MS级胰蛋白酶活性的批间变异性高达25%。
质谱级胰蛋白酶的自体水解显著、消化效率中等和蛋白水解活性的批间变异性大。
3. 新型改良的胰蛋白酶
01
新型改良胰蛋白酶的研发


优化新胰蛋白酶,从而确保最佳裂解特异性和蛋白水解效率、纯度、自体水解抗性以及批间再现性。

<点击上述产品名称可进入产品详情页面>
02
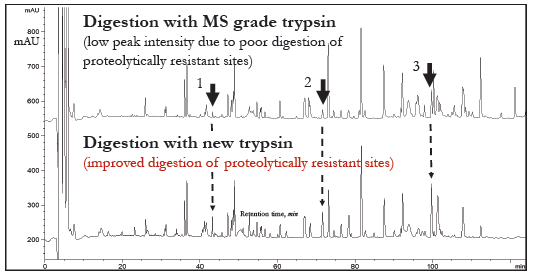
新胰蛋白酶不具有非特异性裂解活性
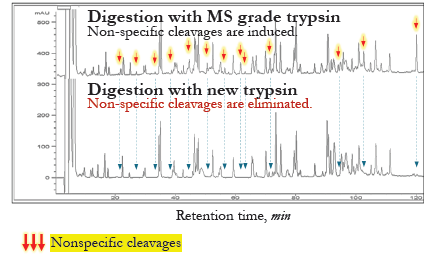
裂解特异性试验:消除非特异性切割活性
过夜消化帕尼单抗抗体(胰蛋白酶与蛋白的比例为1:10),然后进行RPHP-LC-UV或LC-MS分析。
● RP-HPLC-UC分析(Agilent 1200):
● LC-MS分析(Q Exactive Plus,Thermo):
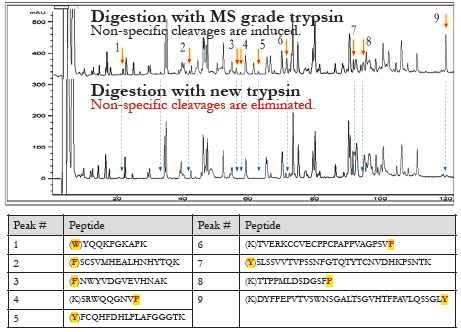
新胰蛋白酶的非特异性裂解活性不可检出。
03
新胰蛋白酶具有自体水解抗性
自体水解试验:抑制自体水解胰蛋白酶肽


新型化学修饰方法确保新胰蛋白酶具有高自体水解抗性。
04
蛋白水解抗性位点的消化
使用递增数量新胰蛋白酶消化消化帕尼单抗抗体
过夜消化消化帕尼单抗并使用RP-HPLC-UV(Agilent 1200)进行分析。
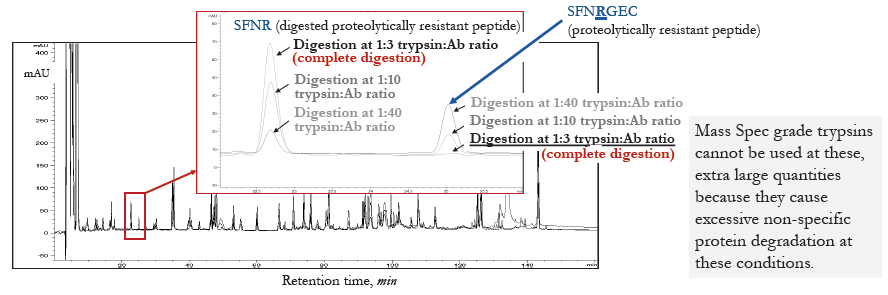
可使用大剂量新胰蛋白酶消化蛋白水解耐性极大的位点。
*补充图右侧说明:质谱级胰蛋白酶不能用在这类超大用量的应用中,因为它们在这些条件下会导致过度的非特异性蛋白质水解。
05
低pH值条件下用新胰蛋白酶表征生物治疗蛋白
低pH值条件下帕尼单抗抗体的消化
于弱酸性(pH值5.5)条件下消化帕尼单抗抗体,并使用RP-HPLC-UV(Agilent 1200)进行分析。
肽图分析时,通过低pH值抑制非酶促蛋白修饰,例如脱酰胺和二硫键重排。
前段时间,Promega开发了AccuMAP™试剂盒用于低pH值条件下消化蛋白。该试剂盒可抑制人工非酶促PTMs,但无法有效消化蛋白水解抗性位点。使用新胰蛋白酶后,低pH值条件下的消化效率得以显著提高。

通过新胰蛋白酶,可实现低pH值条件下非酶促蛋白修饰的精准表征。

产品信息

说明书查询

实验工具

技术资料









