
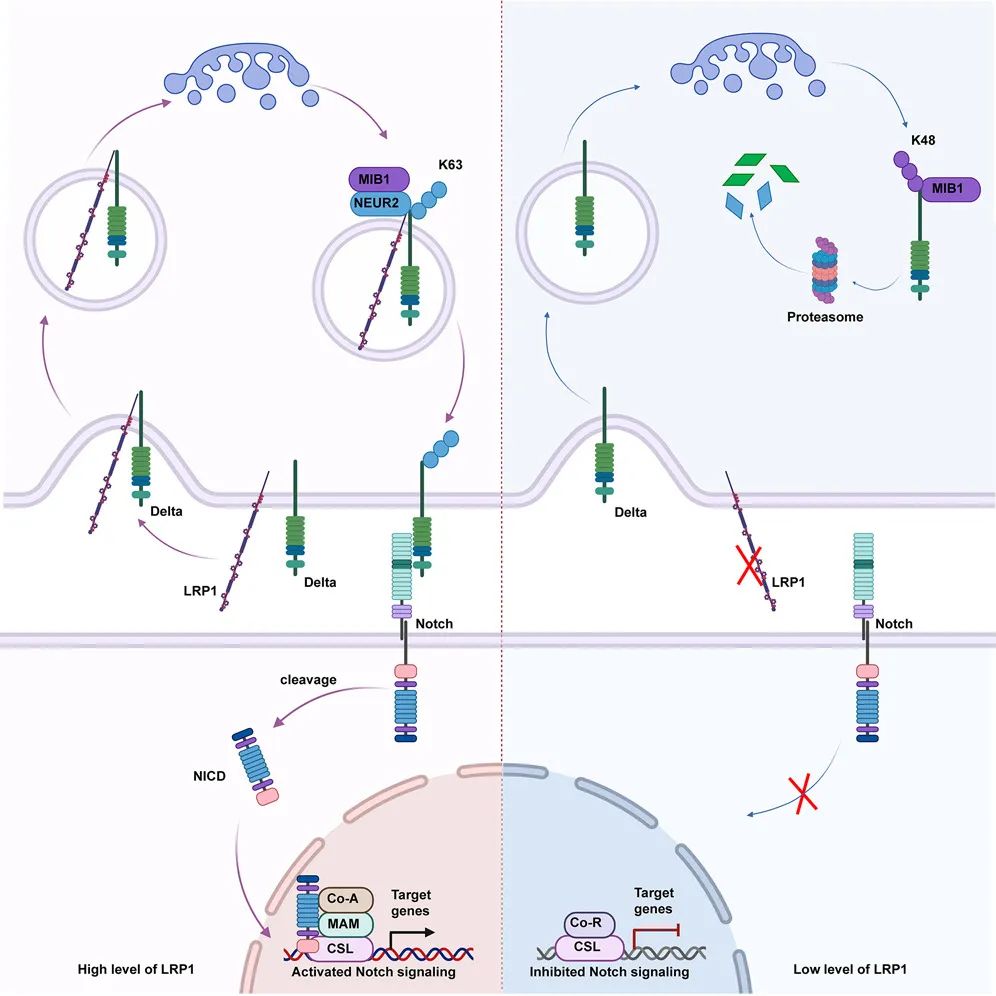
低密度脂蛋白受体相关蛋白1(LRP1)介导Notch信号激活
文中介绍的文章研究者基于串联亲和纯化和蛋白质组学技术建立了Notch通路核心蛋白的互作网络,并通过秀丽隐杆线虫、果蝇和小鼠白血病模型证实LRP1参与Notch通路的活化。本文中文章作者卞维祥博士为您亲自解读文章的实验要点。
文章题目:Low-density Lipoprotein Receptor-related Protein 1 Mediates Notch Pathway Activation
发表期刊:Developmental Cell
发表日期:2021
关键词:DLL3; LRP1; Notch pathway; interaction network; leukemia
作者及单位:西湖大学卞维祥博士/李旭课题组。
文章亮点
● 基于串联亲和纯化和蛋白质组学技术建立了Notch通路核心蛋白的互作网络;
● 多组学数据整合发现LRP1是重要的Notch通路上游调控因子;
● LRP1参与Notch配体Delta泛素化链型的转变,胞内转运、膜定位和稳定性;
● 秀丽隐杆线虫、果蝇和小鼠白血病模型证实LRP1参与Notch通路的活化。
<文章模式图>
实验设计
首先建立表达Notch通路13个核心蛋白的稳转细胞系,利用串联亲和纯化-质谱技术建立Notch通路蛋白互作网络。
随后对蛋白质组学数据,遗传筛选数据和基因组数据进行整合分析鉴定Notch通路潜在的调控因子。
针对Notch配体Delta的研究表明LRP1与DLL3存在相互作用,参与Delta泛素化链型的转变,从而调节其内吞回收、膜定位和稳定性,促进Notch信号激活。
在此基础上,通过线虫和果蝇两种模式生物证实LRP1对Notch信号的调控具有保守性。最后利用小鼠白血病模型证实靶向LRP1可以抑制Notch相关疾病的发展。
主要实验方法
01
串联亲和纯化
收集稳转细胞用NETN裂解,之后利用Turbonuclease对染色质组分进一步消化收集染色质结合蛋白。在细胞裂解液中加入streptavidin beads进行富集,用biotin对富集到的蛋白进行洗脱。之后在洗脱液中加入S beads再次富集,富集产物加入loading buffer进行SDS-PAGE和考马斯亮蓝染色。切取含有蛋白条带的凝胶进行质谱样品处理和检测。
02
Notch信号活性检测
构建含有HES1、HES5启动子的荧光素酶报告基因用于评估Notch信号激活程度。HEK-293T细胞共转染目的基因质粒、萤火虫荧光素酶报告基因和海肾荧光素酶报告基因载体。24h后按照Dual-Glo® Luciferase assay system (Promega)的说明进行细胞裂解和荧光素酶活性检测,并以海肾荧光素酶强度为对照进行归一化处理和分析。对于共培养体系,为了检测相邻细胞间通讯对于Notch信号激活的影响,我们在受体细胞中转染荧光素酶报告基因,配体细胞转染不同的目的基因质粒或进行不同的处理。转染24h后将配体细胞与受体细胞在24孔板中继续共培养24h,按照Dual-Glo® Luciferase assay system (Promega)的说明进行细胞裂解和荧光素酶活性检测。
主要实验试剂
|
产品 |
规格 |
目录号 |
|
Dual-Glo® Luciferase assay system |
10 ml |
E2920 |
登录Promega微网站查询产品详情及经销商联系方式。
主要结果展示
01
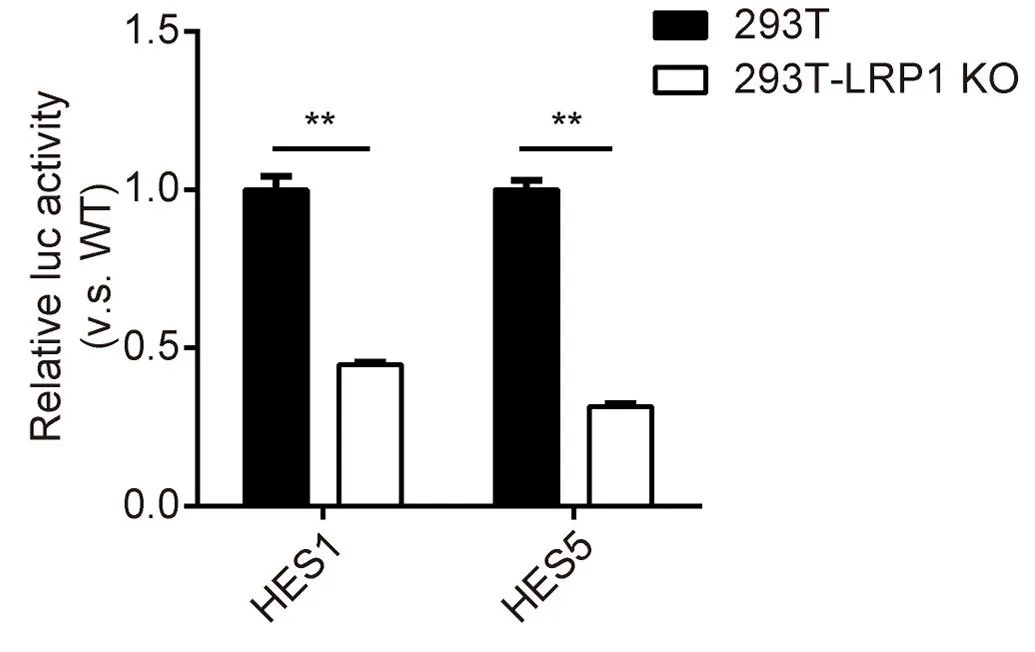
LRP1在Notch信号激活中的调控作用
为了检测LRP1对Notch信号的影响,分别在野生型和LRP1敲除细胞中进行双荧光素酶实验。含有HES1、HES5启动子的PGL3-Luc质粒与Renilla luc共转染至WT和LRP1 KO细胞,并利用双荧光素酶报告基因对Notch信号激活程度进行评估,结果表明敲除LRP1后荧光强度明显减弱,表明Notch活性受到抑制。
02
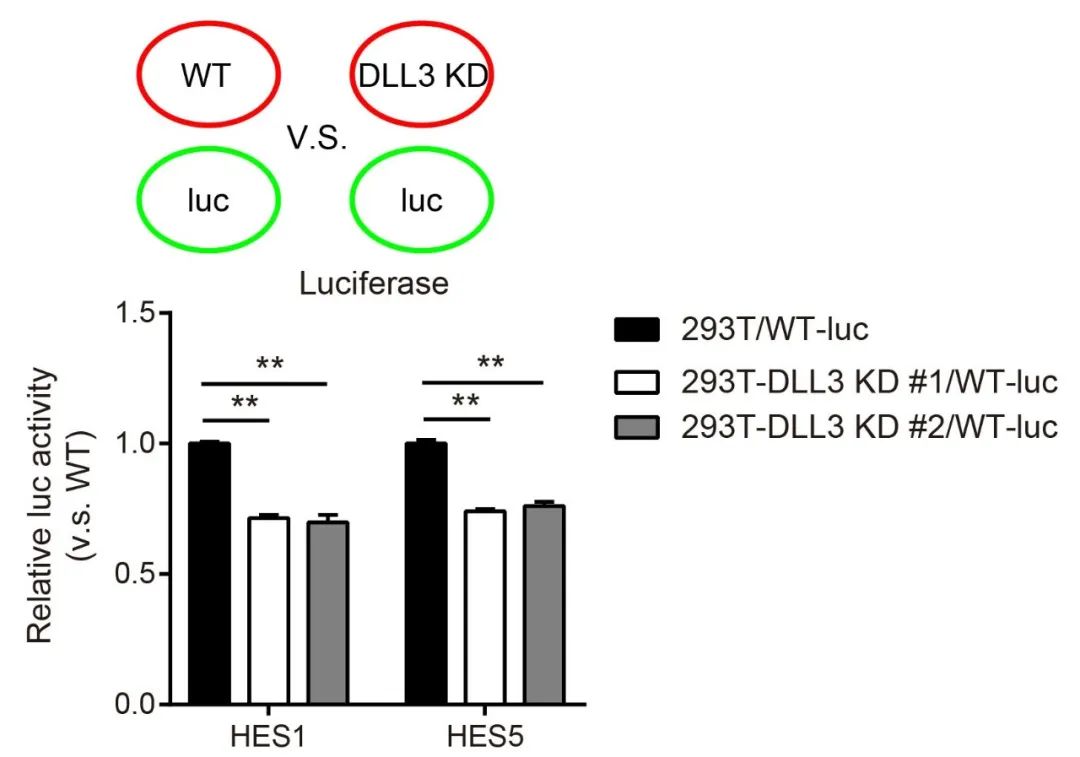
共培养验证DLL3对于相邻细胞间Notch信号激活的影响
为了确定DLL3在细胞-细胞接触中对于Notch信号激活的作用,在受体细胞中转染双荧光素酶报告基因,配体细胞为野生型和DLL3敲低的细胞,转染24h后将配体细胞与受体细胞进行共培养,之后进行荧光素酶活性检测。结果显示敲低配体细胞中的DLL3后会抑制与其接触的受体细胞中Notch信号的激活,表明其在Notch通路中具有正向调控作用。
参考建议
1. Promega的Dual-Glo®Luciferase Assay System (Cat#E2920)能够快速简便地从一个样品中定量两个报告基因的稳定的萤光信号。可直接用于未经过预处理或预裂解的细胞,产生萤火虫萤光素酶和海肾萤光素酶两种发光信号。可以在96或384孔中对含有萤火虫和海肾萤光素酶基因的哺乳动物细胞进行高通量检测。
2. 双荧光素酶报告基因检测会受到多种因素干扰,如转染效率、裂解效率、加样准确度等,因此需要设计3-5个复孔确保实验的可重复性,同时在操作过程中应尽量准确精细,控制好时间。
3. 分析检测数据时应注意样品发光值应远大于背景值,如果样品发光值过小,需要考虑实验过程是否操作有误,实验试剂使用是否有误,需引起注意。
点击此处阅读原文
相关资源
萤光素酶报告基因资源
解决方案下载

双萤光素酶报告基因解决方案

NanoLuc®萤光素酶技术
*请点击图片下载资料
ABOUT PROMEGA
关于Promega公司
Promega Corporation是一家为生命科学行业提供高质量解决方案和技术支持的全球领先生物技术企业。在其44年的历史中,Promega已建立了包含有4000多种支持细胞和分子生物学的目录产品和定制产品的组合。如今,Promega开发的萤光素酶(即荧光素酶)等技术推动了活细胞分析、药物发现、分子诊断和人体识别等领域的创新,并且由实验室科学家和技术人员用于学术和政府研究、法医学、制药、临床诊断以及农业和环境检测。Promega总部位于美国威斯康星州麦迪逊市,在16个国家设有分公司,拥有50多家全球经销商。如需获取更多信息,请访问www.promega.com。
产品信息
说明书查询
实验工具
技术资料













