概述
过继性T细胞免疫治疗是一种重要的癌症治疗策略,该方法通过引入转基因抗原受体使转基因T细胞具有肿瘤特异性并被激活,从而提高它们识别和破坏肿瘤的能力。过继性T细胞免疫治疗可分为T细胞受体改造的T细胞(TCR-T)治疗和嵌合抗原受体T细胞(CAR-T)治疗两种类型。
若使用传统方法测量TCR活化需依靠繁琐的操作步骤和非常易变的终点。TCRαβ-KO Bioassay成功克服了现有方法的局限性,可对转基因TCRs进行功能测试,比如用于质量控制、TCR-T和CAR-T治疗等应用的抗原分级、特异性和安全性试验。
T Cell Activation Bioassay (TCRαβ-KO) 是一种基于细胞的生物发光分析方法,可用于测量转基因TCR构建体在不受内源性TCR表达限制的情况下激活T细胞的效力。该试剂盒由经基因工程改造的Jurkat T细胞系组成,其内源性TCR α和β链通过基因编辑工具CRISPR/Cas9敲除。这些细胞所表达的萤光素酶报告基因由TCR通路依赖性启动子驱动。
优势及应用
- 根据ICH指南已通过资格预审:该生物检测试剂盒证明了其具备在效力和稳定性研究中常规使用所需的精密度、准确度和线性。
- 简单而稳定可靠的操作流程:无需专业技能培训便可操作使用。
- 适合抗体筛选和药物研发:该生物检测试剂盒适于96孔和384孔板操作。
应用:
- 确定CAR-T细胞受体的活性。
- 检测抗原的活性和特异性。
- 测量双特异性抗体的效力和稳定性。
产品信息
该检测试剂盒同样提供细胞库形式(目录号GA1220、GA1210、GA1230)。

检测原理
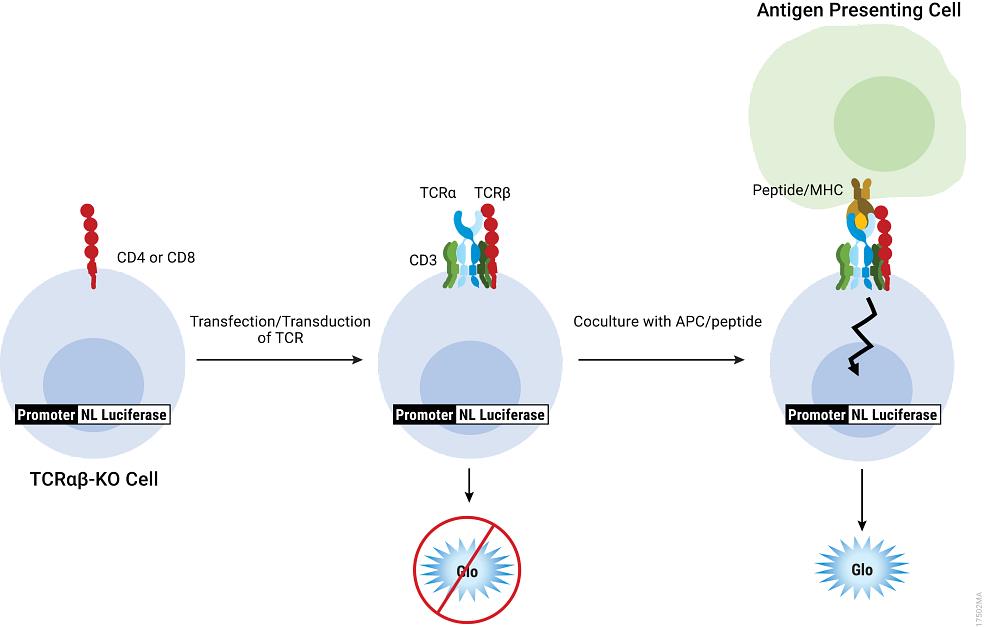
T Cell Activation Bioassay (TCRαβ-KO),Propagation Model利用基于细胞的生物发光报告基因分析方法,克服了现有检测方法的局限性。将TCR α和β链引入TCRαβ-KO细胞可使细胞表面出现转基因TCR的表达。通过表达同源肽和主要组织相容性复合体(MHC)的抗原呈递细胞(APCs),从而激活表达转基因TCR的TCRαβ-KO细胞,再进一步激活有效的TCR和启动子介导的发光。

T Cell Activation Bioassay (TCRαβ-KO)的图示。在不表达转基因TCR的情况下,TCRαβ-KO细胞不会被肽或MHC激活,从而导致较低的光输出。通过转染或转导表达TCR的TCRαβ-KO细胞由APCs和同源抗原激活,从而诱导TCR通路激发出发光信号。
性能数据展示
T Cell Activation Bioassay(TCRαβ-KO, CD4+)的代表性数据 图A. 将TCR转染的亲本Jurkat细胞(内源性CD4+)和TCRαβ-KO (CD4+) 细胞分别与HLA-DR-positive细胞共培养,并滴定同源肽。细胞培养后,加入Bio-Glo-NL™ Reagent并使用GloMax® Discover System对发光信号进行定量检测。图B. 使用Lonza Nucleofector™System将Positive Control TCR Plasmid(或模拟转染)转染进TCRαβ-KO (CD4+) 细胞。转染48小时后,将该细胞与MHCII APC细胞共同培养并滴定Positive Control Peptide。在37°C下、细胞培养6小时后,加入Bio-Glo-NL™ Reagent并使用GloMax® Discover System对发光信号进行检测。
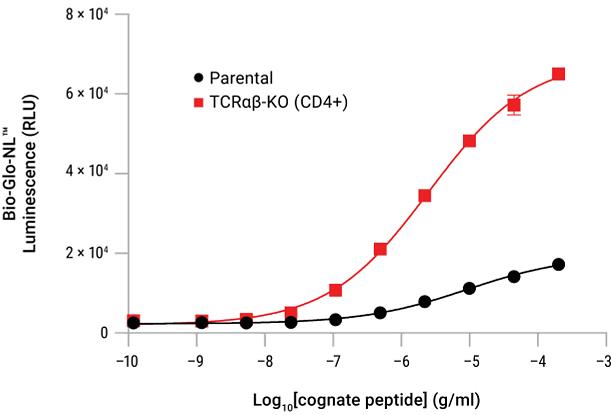 | 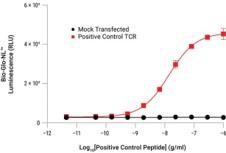 |
T Cell Activation Bioassay(TCRαβ-KO, CD4+)的代表性数据 图A. 将TCR转染的亲本Jurkat细胞(内源性CD4+)和TCRαβ-KO (CD4+) 细胞分别与HLA-DR-positive细胞共培养,并滴定同源肽。细胞培养后,加入Bio-Glo-NL™ Reagent并使用GloMax® Discover System对发光信号进行定量检测。图B. 使用Lonza Nucleofector™System将Positive Control TCR Plasmid(或模拟转染)转染进TCRαβ-KO (CD4+) 细胞。转染48小时后,将该细胞与MHCII APC细胞共同培养并滴定Positive Control Peptide。在37°C下、细胞培养6小时后,加入Bio-Glo-NL™ Reagent并使用GloMax® Discover System对发光信号进行检测。
相关资源







