
生物发光法与传统油红O染色评估脂肪生成性能比较
研究脂肪生成过程,即干细胞分化为成熟脂肪细胞(脂肪细胞)的机制,对于了解糖尿病、肥胖症、心血管疾病、肝病和癌症等疾病的发病机制和寻找潜在治疗方法至关重要。检测脂肪细胞祖细胞在培养物中的脂肪生成能力(例如,受到某些生长条件或化合物的影响)是此类研究的一个基本方向,因此也是该领域研究人员的主要目标。
传统研究方法一般采用基于吸光度检测来评估脂肪生成能力,该检测涉及脂溶性染料,比如油红O。然而,这种检测方法与较新的检测方法相比,存在一些局限性,例如,灵敏度低、定量范围较窄和手动操作时间较长。
本实验通过检测完全分化(成熟脂肪细胞)、部分分化和未分化的3T3L1-MBX成纤维细胞,比较了Triglyceride-Glo™ Assay(生物发光法)与Cayman Chemical Adipogenesis Assay(油红O染色)的定量范围和可用性。
脂溶性油红O染料检测吸光度
非直接定量
操作时间长
直观观察染色
Cayman Chemical Adipogenesis Assay利用脂溶性油红O染料检测样品的脂质含量(主要是甘油三酯)。细胞经染色和洗涤之后,提取出脂质结合染料,然后转移至检测板中测定吸光度。因此,吸光度与样品的脂质含量成正比,并可用于评估脂肪生成;然而,这种方法不能直接进行脂质定量。
主要优势:
油红O通过染色直观地识别细胞分化程度
不同分化阶段的3T3L1-MBX细胞的图像
(放大20倍)
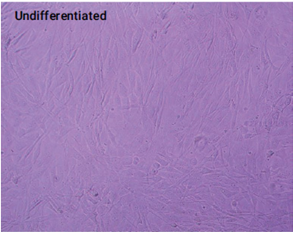
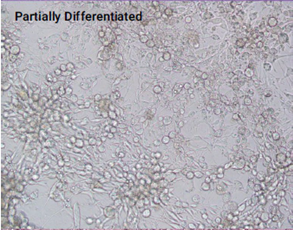
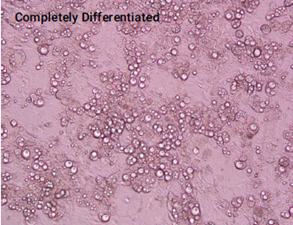
上图. 未分化(左图,实验第20天接种)、部分分化(中图,实验第10天接种)和完全分化(右图,实验第1天接种)3T3L1-MBX成纤维细胞的图像(在实验的第22天拍摄)。使用Triglyceride-Glo™ Assay和Cayman Chemical脂肪生成检测试剂盒检测每个生长阶段的细胞脂肪生成的程度。
使用油红O脂溶性染料染色不同分化阶段的3T3L1-MBX细胞的图像(放大 20 倍)
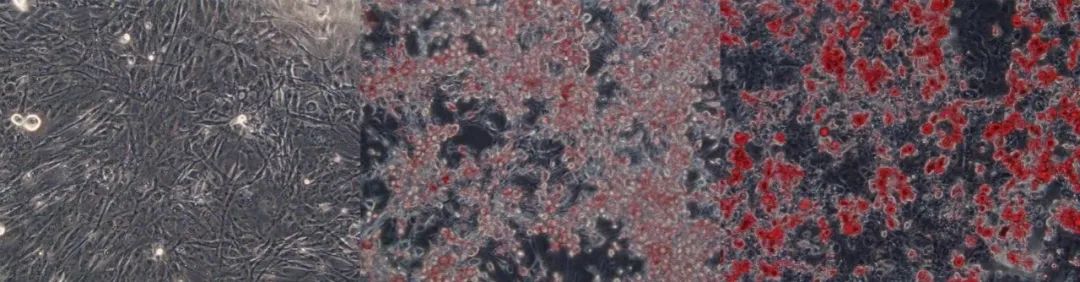
上图. 使用油红O脂溶性染料染色不同分化阶段的3T3L1-MBX细胞的图像(放大 20 倍)。在实验的第22天,使用Cayman Chemical Adipogenesis Assay对3T3L1- MBX成纤维细胞进行固定和染色。未分化(左图,实验第20天接种)、部分分化(中图,实验第10天接种)和完全分化(右图,实验第1天接种)的3T3L1-MBX成纤维细胞的图像。脂质(按重量计约占成熟脂肪细胞的95%以上)结合染料并呈现红色。
主要劣势:
操作时间长,灵敏度低、无法直接定量脂质
1、Adipogenesis Assay需要添加更多的试剂到细胞中,并且还需洗涤至少6次,所以移液操作更多;
2、操作耗时,需要使用许多的移液器吸头,增加了将细胞从孔板底吸出或刮掉的可能性;
3、油红O染色剂在孔的侧面干掉并且洗涤无法去除。这可能会导致测量不准确;
4、根据Adipogenesis Assay标准步骤检测,含有完全分化细胞的孔的吸光度读数范围通常为0.2至0.4,而含有未分化细胞的孔的读数通常在0.05左右。使用该试剂盒可获得的最大S/B比约为8,远低于生物发光法。
发光法甘油三酯检测试剂盒
直接定量
操作简单
信背比高
Triglyceride-Glo™ Assay的发光信号与样品中的甘油量成正比。游离甘油可以通过直接裂解细胞不添加脂肪酶进行定量,总甘油可以通过裂解细胞并添加脂肪酶(将甘油从甘油三酯中释放)来进行定量。然后将检测试剂添加到细胞裂解物中,甘油通过酶偶联化学反应发光。采用甘油标准曲线,将发光信号转换为甘油浓度值,根据游离甘油浓度和总甘油浓度之间的差值,计算甘油三酯的浓度(按重量计约占成熟脂肪细胞的95% ),并评估脂肪生成。
点击下文了解更多产品原理:
主要优势一:定量检测甘油三酯含量
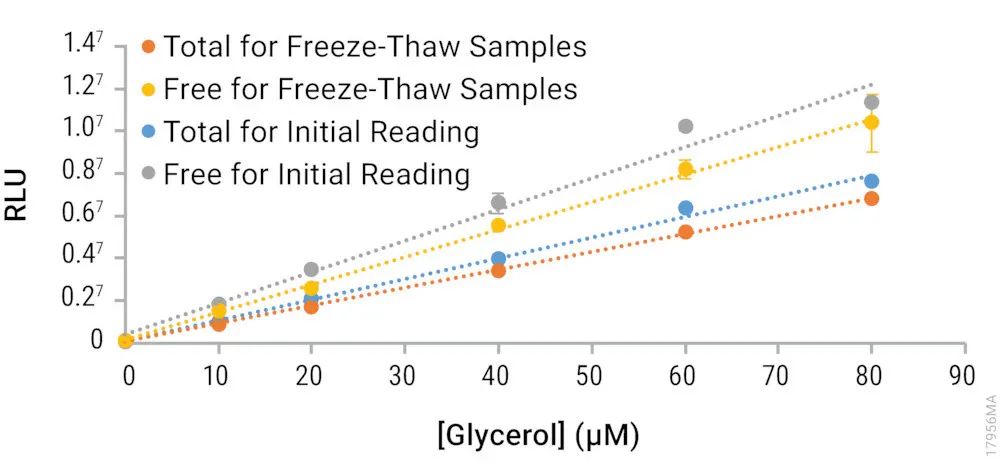
上图.Triglyceride-Glo™ Assay标准曲线。为了确定细胞裂解物的冻融对测定的影响,将细胞裂解物(使用甘油裂解液裂解)在-20℃下冷冻5天。
两种方法评估脂肪生成程度比较
较高的值表示更完整的脂肪生成。两种检测的结果趋势相似,与部分分化细胞和未分化细胞相比,完全分化细胞的结果值更高。虽然这两种分析都是根据甘油三酯的含量来评估脂肪生成,但Triglyceride-Glo™ Assay通过直接测量甘油和甘油三酯浓度定量分析脂质含量,而Adipogenesis Assay只能定性分析细胞的脂质含量。
定量分析vs定性分析
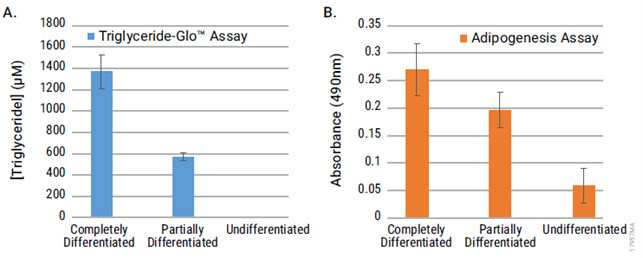
上图.使用两种检测分别检测完全分化(成熟脂肪细胞)、部分分化和未分化3T3L1-MBX成纤维细胞。A. Triglyceride-Glo™ Assay所得甘油三酯浓度±标准偏差(n=9)。根据甘油标准曲线计算并校正稀释度,将按1:25 稀释的总甘油裂解物所得RLU转换为浓度值。由于游离甘油的浓度可以忽略不计,实际上可以认为[总甘油浓度]=[甘油三酯浓度]。B. 脂肪生成检测所得的平均吸光度±标准偏差(n=9)。
主要优势二:高灵敏度和信背(S/B)比
将总甘油细胞裂解物稀释至测定线性范围内后(甘油浓度<80µM),测定成熟脂肪细胞,Triglyceride-Glo™ Assay得出的最大S/B比约为50,Adipogenesis Assay的最大S/B比约为5。Triglyceride-Glo™ Assay约为Adipogenesis Assay的10倍。
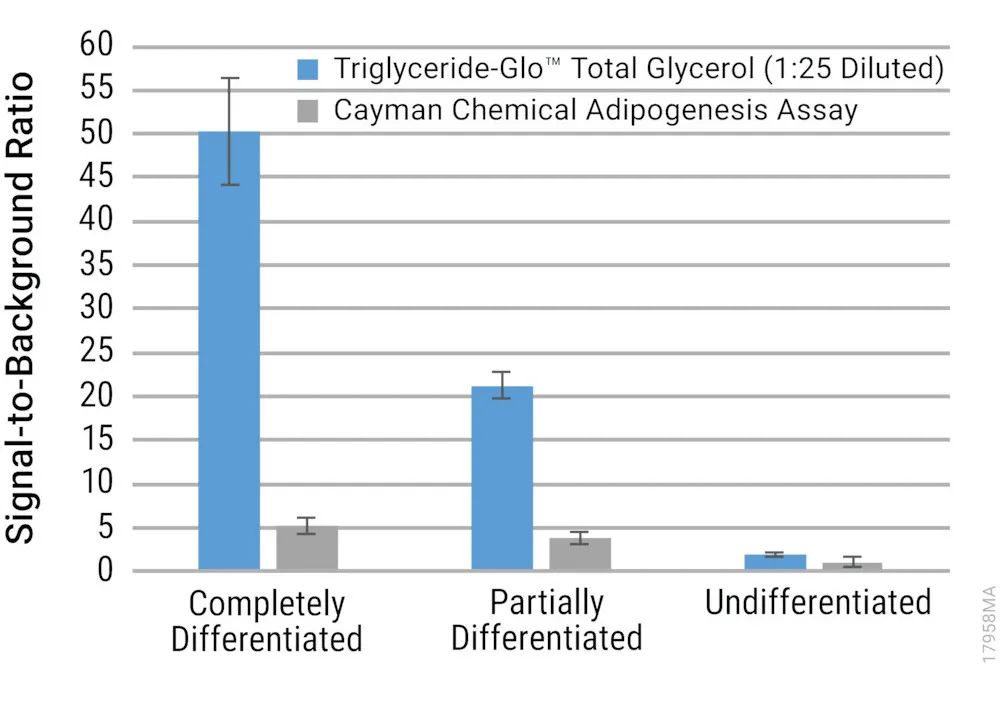
上图.通过Triglyceride-Glo™ Assay和Cayman Chemical Adipogenesis Assay得出的S/B比。使用两种检测分别检测完全分化(成熟脂肪细胞)、部分分化和未分化3T3L1-MBX成纤维细胞。对于Triglyceride-Glo™ Assay,在进行发光测量之前以 1:25的比例稀释细胞裂解物,确保甘油浓度在标准曲线的线性范围内(甘油浓度<80µM)。显示每个检测的平均S/B比±误差(n=9)
主要优势三:操作简单、无需有机萃取
Triglyceride-Glo™ Assay的一般步骤:
洗涤细胞两次,添加裂解液,按需要稀释细胞裂解物,然后添加检测溶液,操作时间更少。基于去污剂的样本制备方法,无需有机萃取。
如需了解更多请联系Promega公司:
电话:010-58256268
公司网址:www.promega.com.cn
技术支持邮箱:chinatechserv@promega.com
相关阅读

产品信息

说明书查询

实验工具

技术资料







