影响PCR成功的因素
PCR是一种相对简单的技术,能够快速可靠地将DNA或cDNA模板扩增数百万或数千万倍,从而生成足够的物质用于后续分析。PCR在20世纪80年代彻底改变了分子生物学,给研究人员提供了一种适合于分析仅微量存在的DNA样品的工具。
PCR技术十分灵敏,只需要非常微量的起始样品,因此PCR不仅在基础研究中极为有用,也能在遗传同一性测试、法医分析、工业质量控制和体外诊断等应用中发挥关键作用。
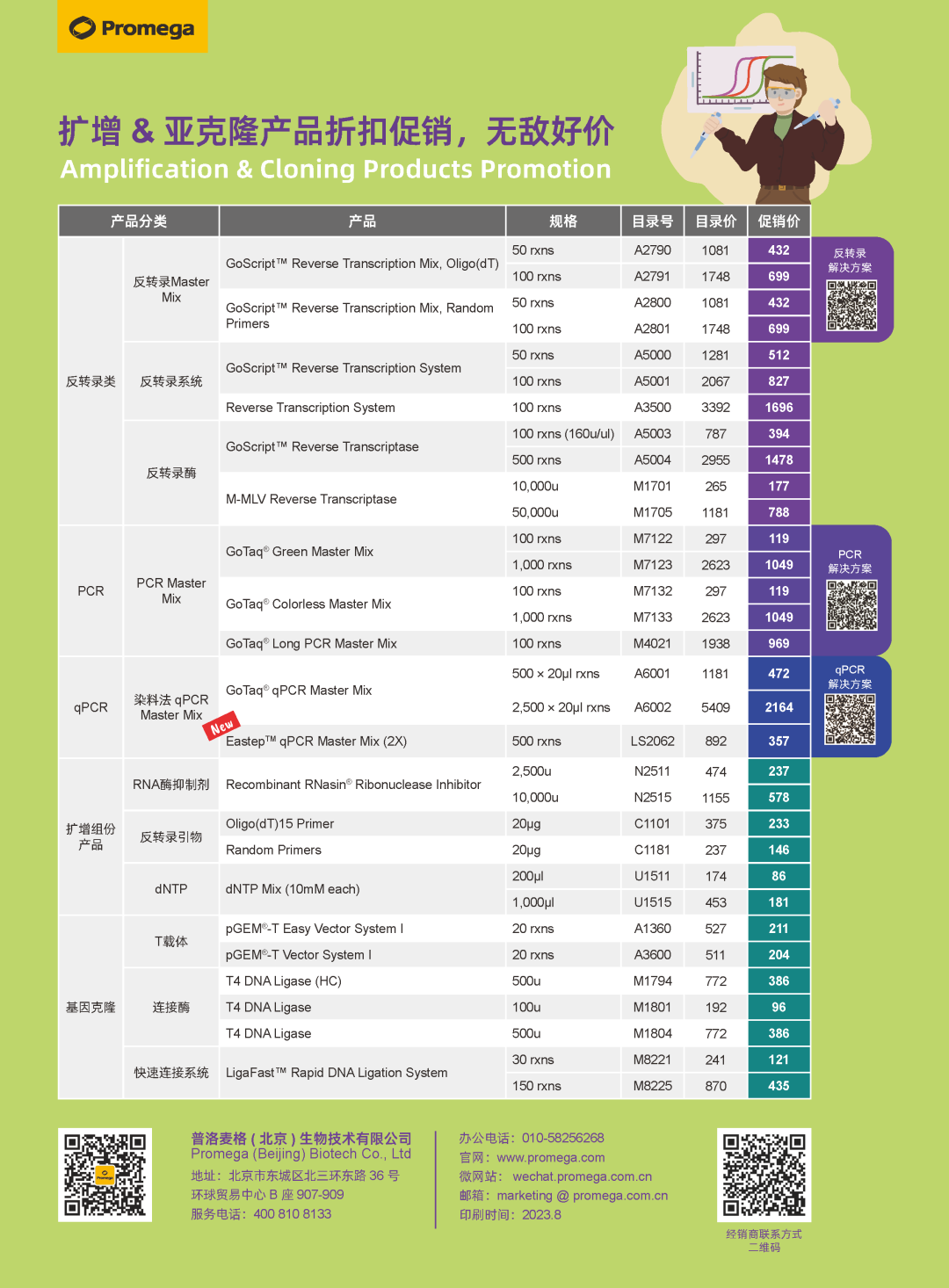
不同的条件可能对PCR产物及产量有重大影响。

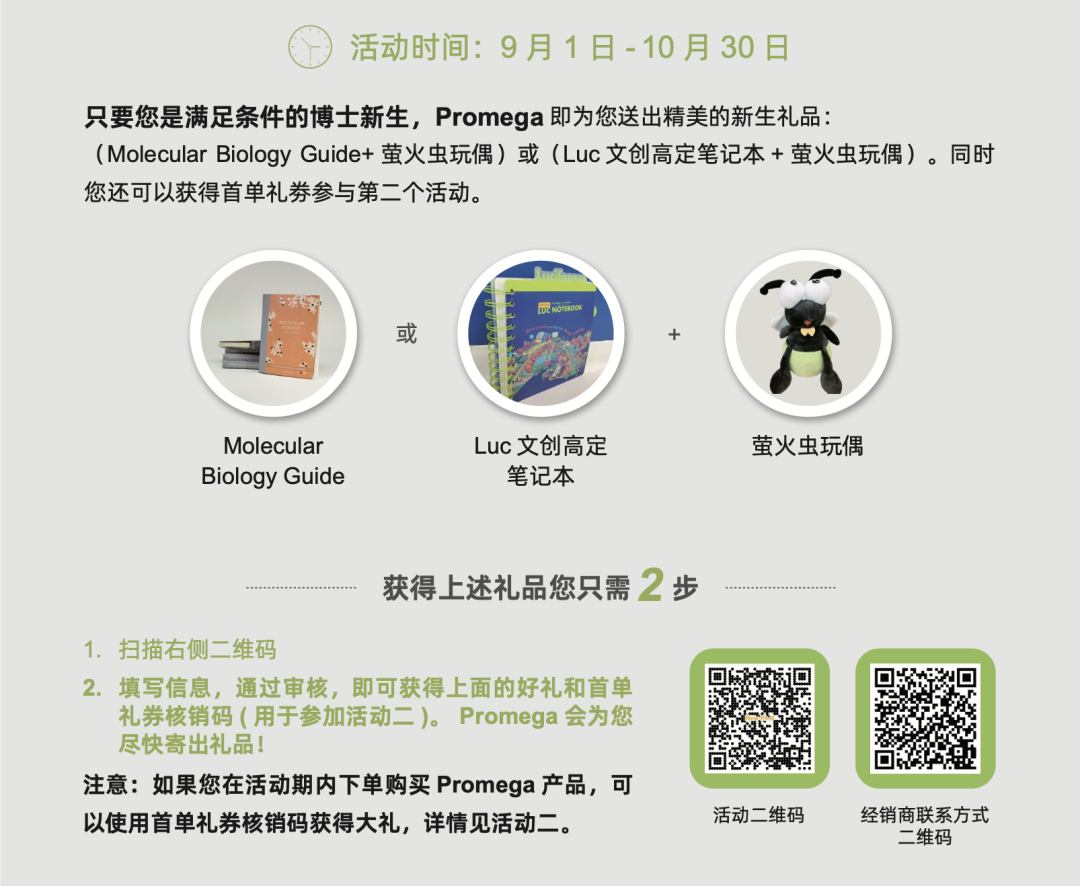
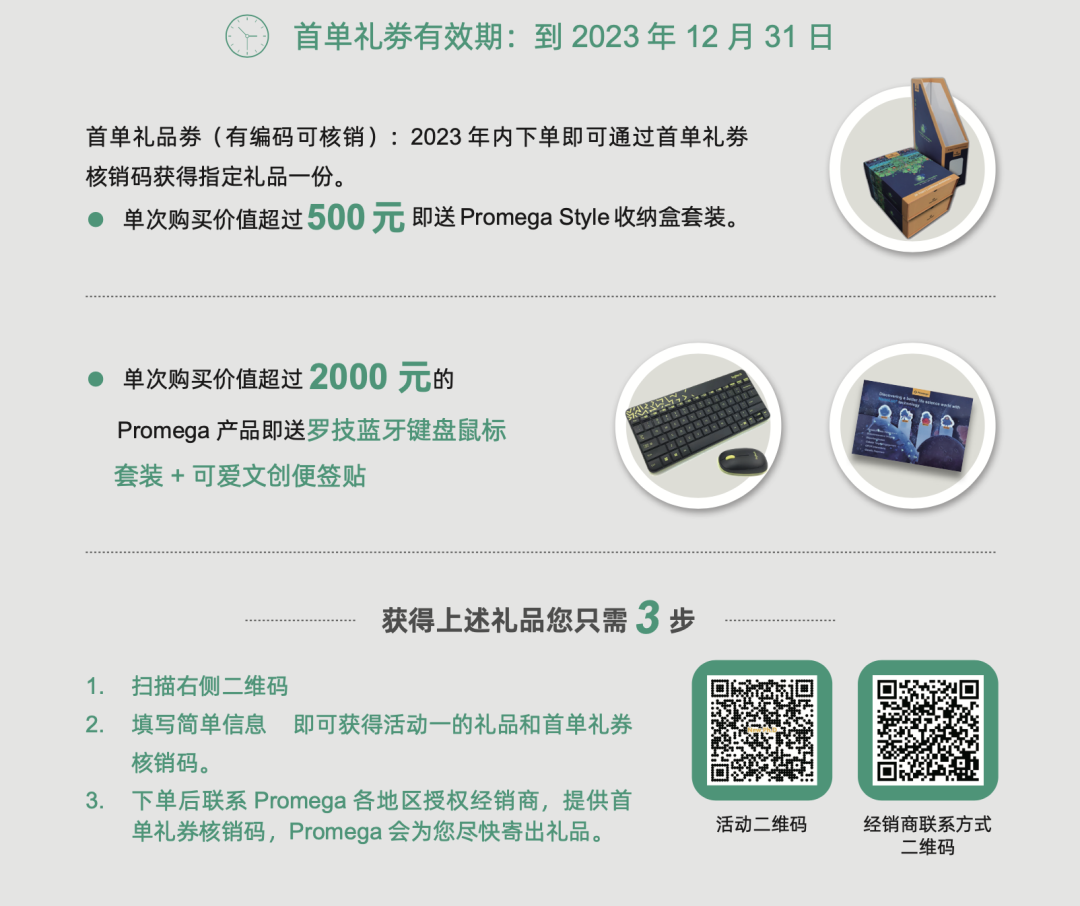
文末更多精彩活动不容错过!
01
使用的酶量
我们建议每50μl使用1.25个单位的耐热性DNA聚合酶进行扩增反应。对于大多数应用,此时酶是过量的。使用更多的酶并不能显著提升产物的产量,而且由于缺乏3‘→5’外切酶活性,Taq DNA聚合酶以及其他不具校对活性的DNA聚合酶甚至可能生成更多非目的产物,尤其是在延伸时间较长的情况下。
温馨提示
导致酶过量的最常见原因是移液误差。几乎无法做到用移液器从50%甘油中吸移不到1μl的酶。因此,强烈建议进行预混合。
02
镁离子浓度
镁离子(即Mg2+)是耐热性DNA聚合酶的必要辅因子,其浓度是影响扩增成功的关键因素。最佳Mg2+浓度因引物、模板、聚合酶和dNTP浓度的不同而不同。
因此,应根据预实验确定每个靶标的最佳镁离子浓度。为此,以0.5-1.0mM的增量设置一系列包含终浓度1.0-4.0mM Mg2+的反应。通过评估结果确定最佳Mg2+浓度,即能够使理想产物的产量最高且非特异性产物的生成量最少的镁离子浓度。许多DNA聚合酶一般配有不含镁离子的反应缓冲液和一管25mM的氯化镁,因此可以进行此类优化实验。
• 对于Taq DNA聚合酶,1.5-2.0mM Mg2+最合适。
• 如果Mg2+浓度过低,则观察不到PCR产物(聚合酶需要Mg2+起作用)。
• 如果Mg2+浓度过高,可能会观察到非特异性PCR产物。
03
引物设计
PCR引物的长度通常为15-30个碱基,设计在目标DNA区域的外侧。引物的GC含量应有40-60%,而且应注意避免可能产生分子间或分子内二级结构(如发夹型物质或引物二聚体)的序列。为了避免产生引物二聚体,引物的3’末端不宜互补。引物二聚体会不必要减少反应中有效的引物量,导致发生有害的聚合酶反应,抑制理想PCR产物的生成。
温馨提示
使用前,充分混匀所有含有氯化镁的溶液。解冻后,氯化镁可以形成浓度梯度,PCR失败的一个常见原因就是没有充分混匀这些溶液。
需避开引物3’端附近的连续三个G或C核苷酸,否则可能导致非特异性引物退火,合成更多不良产物。
理想情况下,两种引物应具有几乎相同的解链温度,让引物能够在相似温度下有效退火。反应的退火温度取决于解链温度最低的引物。另外,应避免在反应中使用高浓度的引物,因为这可能会增加二次扩增( secondary priming ),进而导致生成非特异性扩增产物。尽量使反应中每种引物的浓度为0.1-0.5μM。

关于PCR引物的注意事项
• 大多数引物的长度为15-30个核苷酸。
• 理想GC含量为40-60%。
• 引物对的解链温度应在相互的5°C以内。
• 避免每个引物内出现二级结构。
• 避免PCR扩增中引物之间潜在的二聚化。
• 当在引物末端设计限制性酶切或切割位点时,在限制性酶切位点5’端额外添加4-6个碱基。
04
模板质量
许多化合物可以抑制扩增。这类化合物可能来自核酸的原始来源(如分离出DNA的组织),或者是在纯化过程中引入。可以抑制PRC的常见污染物包括苯酚、乙醇或其他洗涤剂、肝素和盐。通常可以利用酚氯仿抽提然后采取醇沉法除去这些污染物,或使用PCR纯化系统。某些样本类型(如血液、粪便、土壤、真菌和高酚含量的植物等)本身存在问题,因为含有通常能够与DNA共纯化的强力PCR抑制剂。
如果模板样本被降解,PCR扩增也会受到影响。

关于模板DNA的注意事项
• 请使用高质量、纯化后的DNA模板。
• 如需在25-30个PCR循环后检测产物,目标DNA模板需要至少104个拷贝。
• 反应中需使用1pg-1ng的质粒或病毒模板。
• 需使用1ng-1μg的基因组模板。
• 某些情况下,模板并非越多越好。DNA模板浓度较高可以降低特异性。
• 当需要的循环较少时,应使用较高的浓度。
05
模板数量
成功扩增所需模板的数量取决于DNA样本的复杂性。例如,在4kb质粒中(包含1kb作为目标DNA的插入物),25%的输入DNA为目标DNA。
相反,人类基因组中的1kb基因(3.3×109bp)约占输入DNA的0.00003%。每个反应需要大约1,000,000倍以上的人类基因组DNA才能维持与质粒模板相同的目的DNA拷贝数。
常见错误包括质粒DNA、PCR产物使用过多或作为模板的基因组DNA使用过少。DNA模板太少的反应可能会出现非特异性扩增的问题。如果条件允许,目的DNA用量至少从104个拷贝开始,以便在25-30个循环中获得信号,但应尽量将反应的最终DNA浓度维持在10ng/μl以下。当再次扩增PCR产物时,具体PCR产物的浓度通常是未知的。建议扩增前将先前的扩增反应进行1:10到1:10,000倍的稀释。
06
退火温度
引物序列是决定最佳退火温度的主要因素,退火温度通常在引物解链温度的5°C以内。理想情况下,两种引物的解链温度应相似,从而使最佳退火温度接近。如果解链温度相差好几度,则可能需要重新设计其中一种引物,使其解链温度接近另一种引物的解链温度。
一开始,最好将退火温度设定为等于引物的解链温度。如果发生非特异性扩增,则说明退火温度需要提高几度。 如果没有PCR产物,则可能表明退火温度过高,应降低退火温度。如果一直出现不良PCR产物的问题,则考虑使用一种热启动PCR方法。
07
延伸周期
延伸周期的长短可能需要优化,一般取决于PCR产物大小以及所使用的DNA聚合酶。通常,对于不具校对活性的DNA聚合酶,每1kb的扩增子大约需要1分钟。应避免延伸时间过长,否则更有可能生成与Taq DNA聚合酶固有3’→5’外切酶活性相关的人为产物。

关于延伸周期的注意事项
• 延伸通常在68°C下进行。
• 原则上,每1kb的延伸时间为一分钟。
• 对于不足1kb的产物,一般为45-60秒。
• 如果产物超过3kb或反应涉及30个以上的循环,则需要延长延伸时间。
08
循环数
PCR通常涉及25-35个扩增循环。随着循环数的增加,反应中出现不良PCR产物的可能性也会增大,因此循环数需恰当,足以合成理想数量的产物。如果合成足量PCR产物前积累了非特异性扩增产物,需考虑稀释第一次反应的产物,并使用相同的引物将其用作模板进行第二次扩增。或者,在第二次扩增中,可以使用退火至原来扩增子内序列的套式引物生成较小的二级扩增子。

关于循环条件的注意事项
• 反应物放入已预热至95℃的热循环仪中。热循环方案包括初始变性步骤,确保目标DNA完全变性。如果初始变性时间超过2分钟,可能会降低产量。一些热启动聚合酶需要在95℃条件下进行预保温,从而在初始变性前激活聚合酶。
• 优化每种引物的退火温度(退火温度根据引物的解链温度设定)。
• 靶序列的延伸时间应至少为1分钟/kb。
09
反应缓冲液
大多数反应缓冲液由一种缓冲剂(通常基于Tris),和一种盐(一般是氯化钾)组成。缓冲液可以调节反应的pH,进而影响DNA聚合酶的活性和保真度。适当改变氯化钾浓度可以将DNA聚合酶的活性提高50-60%,通常认为50mM的氯化钾最适合。
PCR增强剂和添加剂
加入PCR增强剂可以提高理想PCR产物的产量或降低不良产物的产量。许多PCR增强剂可以通过不同的作用机理发挥作用。这类试剂并不能对所有的PCR起到增强作用;对于不同的模板和引物通常会产生不同的有利影响,因此需要通过预实验来测定。
甜菜碱、二甲基亚砜或甲酰胺等添加剂有助于扩增富含GC的模板以及能够形成稳定二级结构的模板(这类特殊的模板结构可以导致DNA聚合酶停止作用)。富含GC的引物可以形成分子间二级结构,抑制引物退火至模板上。
甜菜碱可以减少分离DNA链所需的能量。二甲基亚砜和甲酰胺的作用方式类似,主要是干扰DNA链之间形成氢键,从而辅助扩增。
对于不加增强剂就扩增不良的某些反应,如果加入甜菜碱(1M)、二甲基亚砜(1-10%),可以提高PCR产物的产量。
一般情况下,BSA(0.1mg/ml)、明胶(0.1-1.0%)和非离子洗涤剂(0-0.5%)等常用稳定剂可以解决扩增失败的问题。这类添加剂可以提高DNA聚合酶的稳定性,并通过吸附到管壁上的方式减少试剂的损失。以往经验表明,BSA还可用于解决黑色素对RT-PCR的抑制作用问题。铵离子可以让扩增反应对非最佳条件的耐受度更高。因此,某些PCR试剂包括10-20mM (NH4)2SO4。其他PCR增强剂包括甘油(5-20%)、聚乙二醇(5-15%)和四甲基氯化铵(60mM)。
温馨提示
如果二甲基亚砜和甲酰胺的浓度分别超过10%和5%,则可以抑制Taq DNA聚合酶。





产品信息

说明书查询

实验工具

技术资料