什么是超分辨率显微成像技术?
What is Super Resolution Microscopy?
传统的荧光显微技术只能成像至约200纳米的分辨率。然而,现代成像技术的进步打破了光的衍射极限,从而诞生了超分辨率显微成像。使用超分辨率技术的成像方法使研究人员能够以纳米尺度观察结构,提供卓越的分辨率和对分子景观的深刻见解。这些技术与特定配体(例如,Janelia Fluor® HaloTag® 配体)的结合使用,让研究人员能够以前所未有的细节来观察和分析分子过程,由此彻底改变了细胞生物学领域。
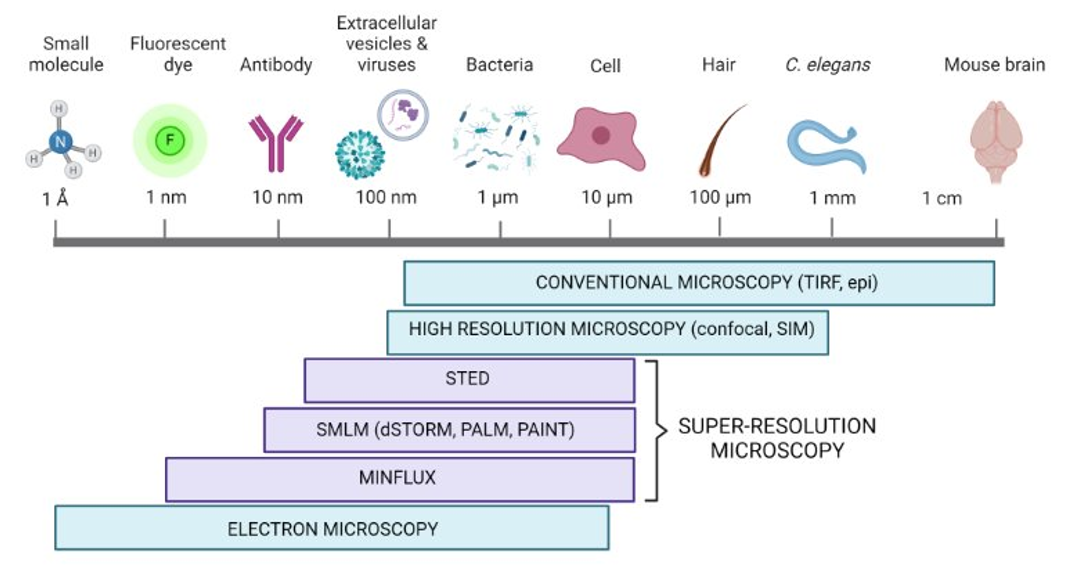
显微镜成像尺度。根据阿贝定律(Abbe’s law),光的衍射极限大约为200-250纳米,这意味着只有大于此尺寸的物体才能使用传统显微镜技术分辨。相比传统的荧光显微技术,超分辨率技术(如STED、SMLM和MINFLUX)可以解析比光的衍射极限小十倍以上的结构。图片由BioRender.com创建。
与超分辨率显微成像相关的常用术语
⦁ 三重态:指荧光团的一种特定能量状态。它比基态具有更高的能量,但与单重态相比,具有不同的自旋状态。自旋状态的不同使得返回基态(及发光)的可能性降低或速度变慢,这可能导致光漂白。
⦁ 衍射极限:传统光学显微镜分辨能力的极限,由光的波长和显微镜镜头的数值孔径决定。换句话说,这是镜头可以聚焦光线的最小斑点尺寸。
⦁ 量子产率:发射的光子数与吸收的光子数之比。量子产率描述了荧光团将激发波长转换为荧光的效率,并且独立于仪器设置。在显微成像中,量子产率影响荧光团的亮度和光稳定性,以及整体图像质量。
Janelia Fluor® HaloTag® 配体
| 更亮的配体,无需洗涤的操作方案 光激活型Janelia Fluor® 染料提供了改进的亮度、量子产率和更长的荧光寿命,使其成为超分辨率显微镜应用的理想选择。它们可穿透细胞膜,适用于活细胞中的单分子追踪实验,并适合如脉冲追踪等活体成像功能检测。 HaloTag®平台允许在不同实验中选择各种不同Janelia Fluor®染料,使得能够使用相同的构建体在具有不同滤光器的仪器上进行多重实验。 |  |
超分辨率显微成像技术的类型
Types of Super Resolution Microscopy
受激发射损耗显微成像(STED)和随机光学重构显微成像(STORM)是最常见的两种超分辨率显微成像技术。在下面的比较表和各节中了解这些技术的更多信息。
| 模式 | STED | STORM/dSTORM |
| 分辨率 | 30-70 nm | 10-55 nm |
| 照明方式 | 激光扫描共焦 | 宽场(落射/全内反射) |
| 采集时间 | 较短(秒) | 较长(分钟) |
| 采集后处理 | 无 | 有(质心识别) |
| 数据量 | 小(1张图像) | 大(多帧) |
| 活细胞兼容性 | 是 | 否 |
| 其他注意事项 | 光漂白 | 过标/欠标伪影 |
超分辨率显微镜技术的应用
Super Resolution Microscopy Applications
⦁ 细胞生物学
超分辨率显微镜技术,如 STED 和 STORM,可以比传统荧光显微镜更精细地揭示细胞内的结构。这包括细胞器、细胞骨架结构和膜复合物的组织结构。分子在复合体中的空间分布改善提供了对分子组装的化学计量和组织的洞见。
⦁ 神经科学
STORM 和 STED 可用于以前所未有的分辨率绘制突触蛋白、树突棘和神经网络的分布和组织,有助于理解突触功能和神经回路。
⦁ 病原体-宿主相互作用
STORM 允许详细研究病原体(如病毒和细菌)与其宿主细胞之间的相互作用,提供感染机制和免疫反应在分子水平上的洞见。
⦁ 直接成像(特定于 STED)
与依赖采集后计算重构的技术(如 STORM)不同,STED 提供实时超分辨率图像。这种直接成像能力简化了过程,并减少了图像重构期间引入的潜在伪影。
STED 显微成像技术
STED Microscopy
什么是 STED 显微成像技术?
受激发射损耗(STED)显微成像技术是一种先进的荧光显微镜技术,超越了传统光学显微成像的衍射极限。STED 显微成像利用受激发射的原理实现纳米级分辨率。
STED 显微成像的工作原理
STED 显微成像的基本原理涉及两个激光束:一个激发激光和一个损耗激光。激发激光首先将样本中的荧光团激发到较高能态。然后使用通常呈环形的损耗激光,将除中心区域外的所有已激发荧光团刺激回基态;在这个非常小的中心区域内,损耗激光的强度为零,因此其中的荧光团仍然保持激发态。
这种选择性损耗有效地缩小了荧光发射区,从而将发射限制在一个亚衍射体积内。通过扫描整个样本上的焦点区域,可以构建出高分辨率图像。
STED 显微成像的优劣势
| 优势 | 劣势 |
| ⦁ 高分辨率 STED 可以达到20-50纳米的横向分辨率,显著超越了传统光学显微镜的衍射极限。这使得能够详细地观察亚细胞结构。 ⦁ 实时成像 STED 提供实时超分辨率成像,无需采集后的图像重构。这使得 STED 更适合活细胞成像和研究细胞内的动态过程。 ⦁ 直接成像 与依赖采集后计算重构的技术(如 STORM)不同,STED 提供实时超分辨率图像。这种直接成像能力简化了过程,并减少了图像重构期间引入的潜在伪影。 ⦁ 定量分析 STED 提供有关样品中分子的空间分布和组织的定量信息,有助于理解分子复合体和细胞结构。 | ⦁ 复杂性和成本 STED 显微镜需要先进的技术和维护,这意味着进入这一应用的成本很高。同样,由于所需的先进硬件和软件,获取 STED 显微成像的初始成本通常明显高于传统显微镜系统。 ⦁ 高光毒性及光漂白 损耗过程需要高强度的光,这可能会对固定和活样本造成不利影响。增加的光强度加速了光漂白过程,即荧光分子在整个成像过程中失去发光能力。 |
如果想避免自发荧光和光漂白,可以通过在细胞和整个动物中使用生物发光成像来实现。
STORM 显微成像技术
STORM Microscopy
什么是 STORM 显微成像
随机光学重构显微成像(STORM)是一种超分辨率显微镜技术,它超越了可见光的衍射极限,使得能够以纳米尺度观察生物结构。STORM 利用单分子定位的原理来实现高空间分辨率。
STORM 显微成像工作原理
STORM 显微成像的核心原理依赖于单个荧光团的精确定位。通过在高度标记的样本中时间上分离单个荧光团的激活和成像,STORM通过激活、成像和定位的迭代循环构建高分辨率图像。以下是STORM的主要组成部分和机制的描述:
⦁ 激活与成像:荧光团以随机的方式在稀疏的子集中被激活,确保在任何给定时间内只有少数发出荧光。这防止了发射点的重叠,从而允许进行精确的定位。
⦁ 单分子定位:每个激活的荧光团的位置通过将其发射光点的扩展函数(PSF)拟合到高斯轮廓来确定,以实现高精度。然后记录下各个荧光团的坐标。
⦁ 图像重构:经过多次激活和成像循环后,从数千到数百万个单个荧光团的累积位置重建出超分辨率图像。
STORM 显微成像的优劣势
| 优势 | 劣势 |
| ⦁ 高空间分辨率 实现10-30纳米的横向分辨率和50-60纳米的轴向分辨率,这是所有超分辨率方法中最高的之一。
⦁ 单分子检测 STORM 依赖于单个荧光分子的精确定位,能够检测并分析单个蛋白质直至单分子分辨率。⦁ 定量数据 该技术提供了有关样品中分子数量和空间分布的定量信息,有助于理解分子的化学计量和分子复合体的组织。 | ⦁ 复杂的样本制备 由于需要可光开关的荧光团,只有有限数量的染料和荧光蛋白与此技术兼容。 ⦁ 缓慢的图像采集 STORM 高度耗时,因为它依赖于捕捉许多连续的图像以重建最终的超分辨率图像。这也使得该技术不太适合动态过程或活细胞成像。 |