

多种类
多功能

蛋白标记是蛋白分析的一个重要方面,可针对多种应用对蛋白进行标记。但是如何为蛋白选择合适的标签,就需要诸多考究了。不过别担心,小麦接下来将为大家介绍多个基于亲和力或基于报告基因的标签和试剂的选择,助大家高效开展实验。想pick谁,你说了算~~

-
蛋白标签介绍
-
蛋白标签选择:包括多聚组氨酸,谷胱甘肽-S-转移酶,HaloTag® 蛋白,HiBiT蛋白标签以及NanoLuc® 萤光素酶
-
HiBiT蛋白标签技术优势
-
相关产品清单

蛋白标签介绍
蛋白或多肽是细胞功能的组成部分。它们是构成能量代谢、细胞生长、信号传递、细胞分裂周期和细胞死亡途径的酶。能够分离和检测特异性蛋白使我们能够理解哪些蛋白为较大复合物的一部分,哪些蛋白会发生相互作用以及蛋白在细胞功能和疾病治疗中的作用。检测蛋白功能的方法之一是在靶蛋白上添加一个标签,并将蛋白从细胞裂解物中分离出来进行研究。
融合标签可以是添加至蛋白的氨基(N)或羧基(C)末端的多肽、小分子蛋白或酶。标记可通过克隆至载体中来进行,或使用CRISPR-Cas9基因编辑标记内源性蛋白来添加。通过使用亲和标签,可分离或固定一种蛋白用于额外蛋白组学研究。
尽管研究者通常是通过标记蛋白来从细胞裂解物中对其进行纯化,并在生化检测中使用分离的蛋白,但肽标签可以有更多的作用。例如,如果没有针对您靶标蛋白的特异性抗体,则可以用标签特异性抗体来检测带有抗原表位标签的蛋白。此外,标签还可以定量蛋白,研究蛋白复合物,确定蛋白是在细胞内还是外。借助于蛋白上的标签,甚至可以看到蛋白在细胞内的位置。
重点来喽
想知道哪个蛋白标签适合自己的实验?别着急,小麦马上为大家奉上标签蛋白和它们对应的工具试剂的选项清单~~请继续浏览下文吧

蛋白标签选择
多聚组氨酸
多聚组氨酸标签的介绍
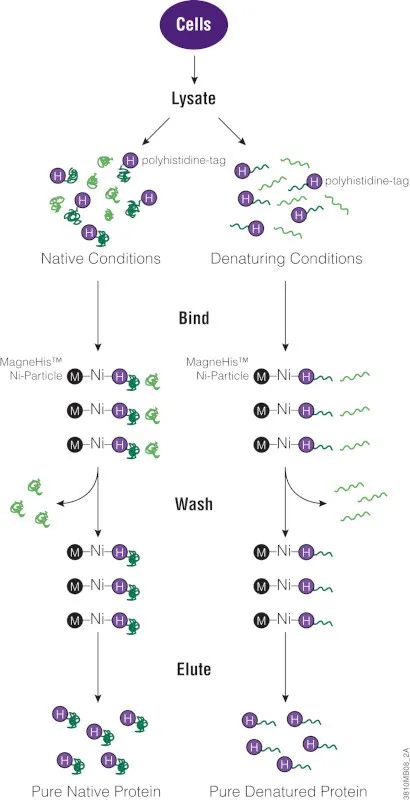
最简单和最小的标签之一是多聚组氨酸标签或6XHis标签。通常此类肽标签由六个组氨酸组成,可被置于蛋白的N末端或C末端。由于His标签较小,通常不会改变蛋白结构,因此可用于下游检测分析。此外,His标签还可结合Ni 2+、Zn 2+和Cu 2+等金属离子,这使其可用于纯化或固定融合蛋白。
多聚组氨酸标签的应用
多聚组氨酸标签能够快速纯化在大肠杆菌中表达的蛋白,但对于在哺乳动物或昆虫细胞中表达的蛋白而言,组氨酸残基的数量越多意味着本底结合越高。因此,为了提高蛋白纯度,与 His标签蛋白结合的金属树脂需要严格清洗。此外,8M尿素或6M盐酸胍等变性剂可与His标签膜或不溶性蛋白一起使用,从而提高纯化效果。
如何将多聚组氨酸标签添加至目的蛋白
要把His标签添加至蛋白,可将ORF克隆至携带标签的载体中。根据所用的启动子,在细菌、哺乳动物或昆虫细胞中表达标签蛋白。或者,也可使用无细胞表达系统进行蛋白表达。如需纯化蛋白,可针对细胞裂解物使用磁珠(见文末:蛋白纯化[1])或非磁性树脂(见文末:蛋白纯化[2])。如果His标签蛋白在基于兔网织红细胞裂解物的系统中表达,则(见文末:蛋白纯化[3])可以用于蛋白纯化,减少血红蛋白的干扰。标签蛋白一旦从纯化基质中洗脱出来,即可随时用于下一步研究。
< 下图:多组氨酸标签蛋白纯化 >
谷胱甘肽-S-转移酶(GST)
GST标签的介绍及应用
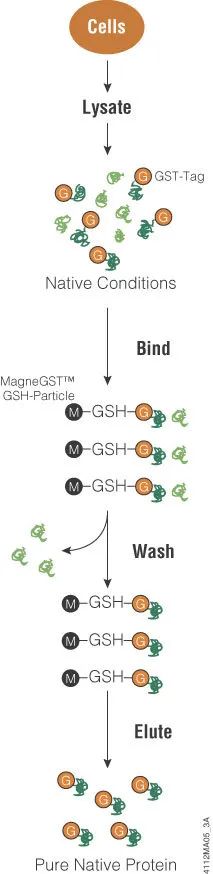
谷胱甘肽-S-转移酶(GST)是一种亲和标签,用于在大肠杆菌中表达的蛋白,以从细菌裂解物中纯化标签蛋白。这个26kDa的肽标签是存在于真核生物中的胞内蛋白家族的一部分,当试图从真核细胞中分离蛋白时,由于与其他蛋白的竞争,此类标签变得无足轻重。当在细菌中表达时,用GST标记真核生物蛋白能够增强融合蛋白的溶解度。此外,GST标签蛋白可以在细菌中高水平表达,但可能会因为蛋白聚集而形成包涵体。GST标签可以添加至靶蛋白的N末端或C末端。
GST对谷胱甘肽有很强的亲和力,这意味着可在类似谷胱甘肽包被的磁珠等固定化基质上捕获GST蛋白融合物。这种结合特性可用于蛋白纯化以及捕获可能与靶标蛋白结合的多种蛋白(例如,pull-down检测)。
GST标签的大分子量带来的影响
尽管带有GST标签的蛋白能够高水平表达且更易溶解,但标签的分子量大可能会干扰下游应用中的蛋白功能。也许可以通过将目的蛋白从GST标签上切掉,来减少可能的功能干扰。如果表达的蛋白聚集成包涵体,使用谷胱甘肽进行亲和纯化便会出现问题。GST需要正确折叠才能成功结合谷胱甘肽,而且即使GST标签可以重新折叠,靶蛋白也未必能够重新折叠。
如何将GST标签添加至目的蛋白
如需使用GST标签,可先将靶蛋白的编码区克隆至载体中,然后在大肠杆菌中表达标签蛋白。使用诱导型启动子来调控靶蛋白的表达有助于处理对细菌细胞有毒性的蛋白。一旦裂解细菌细胞(见文末:细胞裂解液[1]),即可使用基于谷胱甘肽的树脂(见文末:蛋白纯化[4])纯化标签蛋白。根据所用的克隆载体,可能会有一个蛋白酶的切割位点来去除蛋白中的GST标签。一旦洗脱或切下蛋白,即可随时进行分析。
< 下图:纯化GST蛋白融合物 >
HaloTag®蛋白
HaloTag®蛋白标签的介绍
尽管GST标签和6XHis标签均可用于分离细菌细胞中表达的蛋白,但也有与大肠杆菌和哺乳动物细胞均兼容的标签可选择。34kDa的HaloTag®蛋白便够使此类表达系统更具有灵活性。与其他使用非共价相互作用来纯化蛋白的标签不同,HaloTag®技术的基础是HaloTag®蛋白与其配体之间的共价结合。考虑到共价键的强度,您可以在严格的条件下洗涤结合的标签蛋白,基本上可以消除任何非特异性蛋白本底。担心标签的大小会影响蛋白功能?无需担心!仅需使用TEV蛋白酶从HaloTag上将蛋白切下来,纯化后的无标签蛋白即可随时用于下游分析。
HaloTag®蛋白标签的优势表现
在细菌细胞中表达蛋白的挑战之一便是溶解度。真核蛋白在大肠杆菌中合成时未被甲基化,也缺乏其他翻译后修饰,这使得真核蛋白极易形成包涵体。HaloTag®蛋白等融合标签能够使重组蛋白更易溶解,甚至能够增强其在细菌中的表达,从而使靶蛋白更易纯化。通过在哺乳动物细胞中表达HaloTag-融合蛋白,进行翻译后修饰,更能反映蛋白在细胞条件下的运作方式。
HaloTag®蛋白标签的应用
使用固定化基质,如包被HaloTag®配体的树脂,可以仅纯化包含HaloTag标签的蛋白或用于pull-down检测,以发现与靶蛋白结合的一种或多种蛋白。通过这种方式,能够更好地理解蛋白间的相互作用。
但是该应用并不仅限于蛋白间的相互作用和蛋白纯化。如果想要探究蛋白与哪些DNA序列结合,则HaloTag®技术有助于破译蛋白与DNA的相互作用。如果您需要使用免疫化学的方式进行检测?我们有针对该方面的抗体。如果您对细胞成像感兴趣?只需将靶标蛋白与HaloTag®蛋白融合和荧光HaloTag® 配体配合使用,你可以观察蛋白的定位,是否被转运以及这件事发生地有多快。甚至还有可用于超分辨率显微镜技术和FACS的配体。
点击此处了解更多HaloTag®技术详情。
如何将HaloTag®蛋白标签添加至目的蛋白
如需使用HaloTag®技术,请在传统的多克隆位点载体或Flexi®克隆载体中克隆靶蛋白的编码区,以便在N末端或C末端添加HaloTag®。或者,也可以从Kazusa成千上万个预先构建的HaloTag®克隆中搜索并购买您需要的那一个。一旦有了克隆子,即可将其用于任何蛋白分析应用。根据您下一步的实验操作,可能需要一个纯化系统(见文末:HaloTag®蛋白纯化系统[1]或[2])或一项pull-down检测(见文末:Pull-Down检测系统[1])。对于成像研究而言,需要选择合适的荧光配体(见文末:HaloTag®配体[1]或[2])。如果对免疫学研究感兴趣,Anti-HaloTag® pAb将大有帮助。对于蛋白互作而言,NanoBRET™ PPI Systems适用于蛋白间的相互作用研究,而HaloCHIP™ Systems适用于检测蛋白与DNA的相互作用。
< 下图:HaloTag®可替换标签技术 >
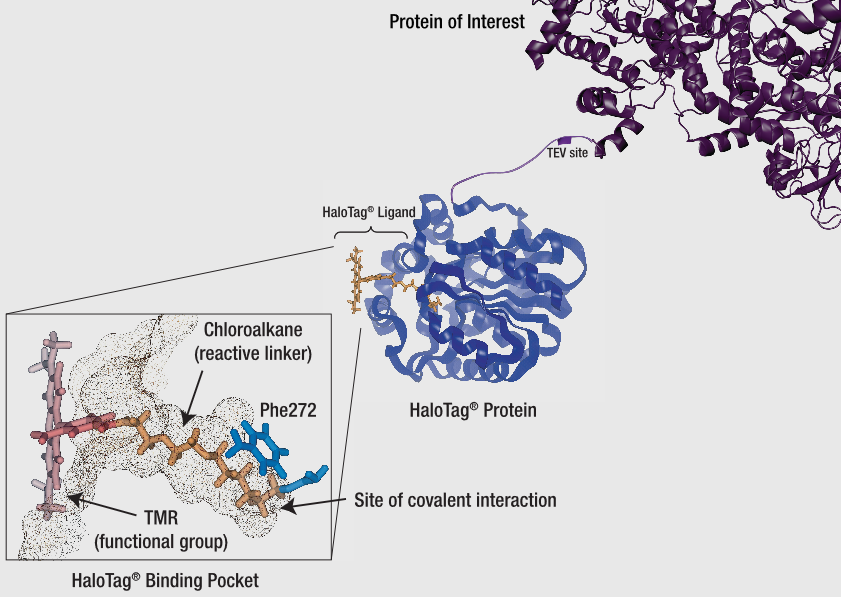
此图显示了如何将HaloTag®蛋白融合至目的蛋白上,以及HaloTag®与其配体之间的共价结合。
HiBiT蛋白标签
HiBiT蛋白标签的介绍
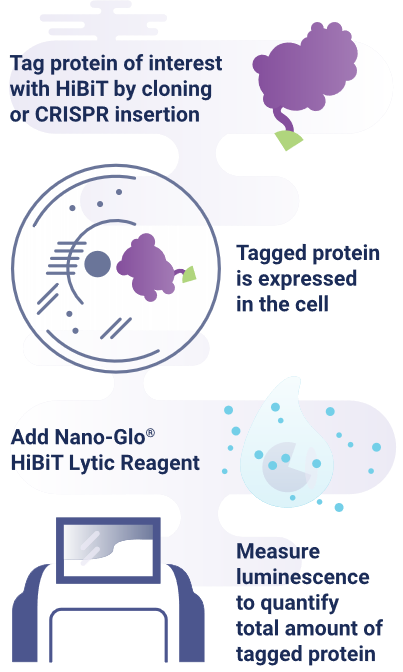
从多个方面来说,蛋白标签的体积越小越好,而一种具有11个氨基酸的极小的肽标签(称为HiBiT)就非常适合标记蛋白。就其本身而言,HiBiT不具有生物发光性。然而,一旦加入含有互补LgBiT蛋白的检测试剂,便会产生明亮的发光信号。使用发光检测仪能够轻松测量信号值。生物发光检测非常灵敏,精确度可以准确到纳摩尔量级。
HiBiT蛋白标签的应用及优势
如果希望跳过传统的克隆方法,您可以使用CRISPR基因编辑将HiBiT标签添加至内源性蛋白中。这样做的优势在于,当研究蛋白时不必担心过表达造成的困扰,而这是使用质粒进行外源表达时典型的问题。通过将细胞蛋白保持在其在细胞中发现的相同比例水平,就能够研究生理条件下标签融合靶蛋白的变化。此优势意味着由蛋白过表达产生的假象较少,生物学相关性较高。用CRISPR方法添加肽标签的操作很简单,像HiBiT这样的小肽段可以达到很高的编辑效率。
如果您希望检测胞外蛋白或分泌蛋白,我们有一套针对该方面的试剂系统!将总标签蛋白定量与我们的裂解系统相结合,并使用我们的胞外系统检测分泌蛋白水平。使用我们的生物发光印迹系统来检测膜上的蛋白,甚至可以不再需要抗体。如果在胞内表达LgBiT,则可以动态检测活细胞中的HiBiT标签蛋白丰度。
如何将HiBiT蛋白标签添加至目的蛋白
如需开始使用HiBiT,可将靶蛋白ORF克隆至我们传统的MCS或Flexi®载体中,或者使用CRISPR方法将标签添加至基因组序列中。将标签置于所需的位置以便获得最佳的检测。一旦用HiBiT标记蛋白,就可以选择最适合开展研究的方法(Nano-Glo® HiBiT裂解系统、胞内系统或印迹系统)。点击此处可查阅更多关于使用HiBiT进行蛋白标记的详细信息。
< 下图:Nano-Glo® HiBiT裂解检测系统综述 >
NanoLuc®萤光素酶
NanoLuc®萤光素酶的介绍
NanoLuc®萤光素酶是一种19kDa的酶,这使得这种生物发光蛋白小到可以与另一种蛋白搭在一起,而不会干扰靶蛋白正常的细胞功能。与HiBiT相似,NanoLuc®提供一种灵敏的、易于定量的蛋白融合标签。但报告基因这类酶无需互补伴侣,从而简化了其在一些应用中的使用。亮度和小体积意味着NanoLuc®萤光素酶能够插入病毒中且不会有任何困难。点击此处查看案例分析。
NanoLuc®萤光素酶的应用
作为一种报告基因酶,NanoLuc®萤光素酶可帮助检测融合蛋白的细胞定位,并跟踪蛋白可能的调控路径。此外,NanoLuc®融合蛋白可在基于生物发光共振能量转移(BRET)的应用中用于研究蛋白:蛋白相互作用或小分子药物靶标的检测。点击此处了解该报告基因酶的更多功能。
如何将NanoLuc®萤光素酶与目的蛋白融合
如需与NanoLuc®萤光素酶实现蛋白融合,可将靶蛋白ORF克隆到NanoLuc®报告载体上,并将NanoLuc® 融合在N或C末端。根据所选择的应用,可使用裂解检测系统(见文末:Nano-Glo® 检测系统[1])或活细胞检测分析(见文末:Nano-Glo® 检测系统[2])。
大家可基于实验需要为蛋白选择标签。无论是需要一种蛋白纯化的亲和标签,还是希望产生单一融合蛋白并用于多种蛋白分析方法中,或是利用CRISPR-Cas9基因编辑来添加内源性标签,Promega都有一系列的标签和报告基因酶供大家选择。

HiBiT蛋白标签技术优势
-
用极小标签实现无抗体内源性蛋白检测
-
可检测低丰度蛋白
-
获得更高的标签插入率(CRISPR/Cas9基因组编辑)
-
无需克隆,省时省力
-
HiBiT标签不会干扰目的蛋白
-
HiBiT检测操作简单,不涉及抗体阻断、洗涤或抗体孵育
-
易于检测原代细胞中的内源性蛋白
-
实时检测活细胞中的蛋白
点击此处了解更多HiBiT标签优势的详细信息。

相关产品清单
-
蛋白纯化
[1] MagneHis™ Protein Purification System
[2] HisLink™ Protein Purification System
[3] MagZ™ Protein Purification System
[4] MagneGST™ Protein Purification System
-
细胞裂解液
[1] FastBreak™ Cell Lysis Reagent
-
HaloTag®蛋白纯化系统
[1] HaloTag® Mammalian Protein Purification System
[2] HaloTag® Protein Purification System
-
Pull-Down检测系统
[1] HaloTag® Mammalian Pull-Down Systems
-
HaloTag® 配体
[1] HaloTag® Ligands
[2] Janelia Fluor® HaloTag® Ligands
-
Nano-Glo® 检测系统
[1] Nano-Glo® Luciferase Assay System
[2] Nano-Glo® Live Cell Assay System
—END—



长按识别二维码关注我们

普洛麦格(北京)生物技术有限公司
(Promega Beijing Biotech Co.,Ltd)
地址:北京市东城区北三环东路36号环球贸易中心B座
907-909
电话:4008108133 (手机拨打)
8008108133 (座机拨打)
技术支持邮箱:
chinatechserv@promega.com







