新冠病毒mRNA疫苗:希望与挑战
mRNA Vaccines for COVID-19: The Promise and Pitfalls
疫苗研发现状
COVID-19大流行使得全球范围内针对SARS-CoV-2的药物治疗和疫苗开发力度不断加强。继辉瑞/BioNTech和Moderna两款新冠疫苗获批上市后,阿斯利康(AstraZeneca)公司于2月4日也正式宣布了其与牛津大学联合开发的一款基于复制缺陷型黑猩猩腺病毒载体的新冠疫苗(AZD1222)3期临床试验的主要分析结果。数据显示接种一剂AZD1222能够产生76%的保护效力,如果两次接种之间间隔12周以上,疫苗的保护效力可达82%。这对当前新冠肺炎的防治无疑又是一大利好消息。
但不得不说疫苗研发目前仍然面临着各种各样的挑战。尤其是新冠突变病毒的出现,使得对SARS-CoV-2病毒的生物学特性有更全面的了解就显得非常重要。Promega作为生命科学领域的资深供应商,拥有多项技术用于监测病毒发病机理中关键步骤的研究,并提供合作支持以及广泛的试剂组合,这些试剂可在研究冠状病毒和其他新兴病毒性疾病的研究实验室中得到应用。
Promega新冠病毒研究解决方案:
更多详细信息可点击此处查看
疫苗开发的历程
其实就发展历史而言,免疫接种基本概念已存在超1000多年(始于天花接种):通过使健康个体接触少量病原体,从而增强疾病免疫力。但是直至1796年,Edward Jenner才取得了突破性发现,他当时使用了源于牛痘脓疱的材料对人进行免疫接种,从而预防天花。
现代疫苗开发基于基因组学、结构生物学、对病原体的充分了解,采用多种技术手段设计和生产有效的疫苗产品。虽然技术取得了较大进展,但传统疫苗开发仍面临着重要的挑战。例如开发过程耗时较久,从初步研究至上市可能需要10至15年的时间(1)。蛋白抗原或病原体通过专用发酵或细胞培养装置制备所得。此类专用设备需大量资金投入,因此设备生产商存在重大的财务风险(2)。最值得注意的是,此开发过程并不适用于需要快速响应的情况,例如全球大流行病。
核酸疫苗研发
一种前景光明的传统疫苗开发替代方法是使用核酸(DNA或RNA)进行疫苗研发。此概念并不新颖。1990年,一项开创性实验表明,将DNA或RNA直接注射至小鼠肌肉组织中可导致编码基因的内源性表达(3)。核酸生产工艺比蛋白或病原体培养工艺的复杂程度相对更小,而且还可根据实际需求快速扩展。由于不同编码抗原可采用相同工艺,因此可使用相同生产设备生产不同疫苗,从而压缩生产时间和成本(2)。
图1.
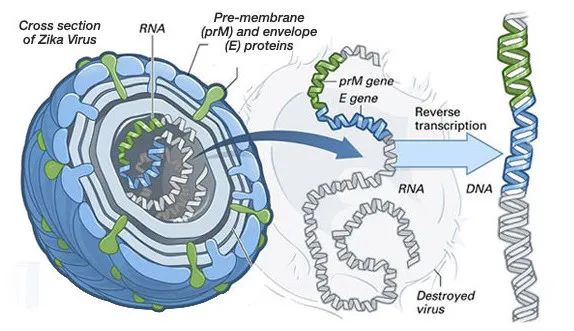
图2.
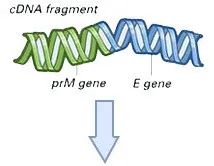
图3.
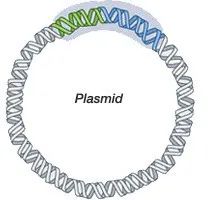
图4.
图5.
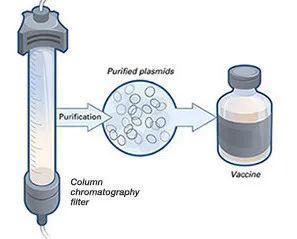
DNA和RNA疫苗均可导致人细胞内抗原的产生(与实际病毒感染时抗原产生方式一致)。但是,由于疫苗仅编码病毒蛋白(或蛋白亚基),而不是完整病毒基因组,因此不存在实际病毒感染的风险。1998年,报道了预防人类免疫缺陷病毒1型(HIV-1)的DNA疫苗的首项人体试验(4)。此后,还开发出了预防多种病原体的DNA疫苗,包括B型肝炎、流感、埃博拉病毒和Zika病毒等疫苗(5)。但是,目前尚无批准用于人类的DNA疫苗。
为何选择mRNA?
DNA疫苗存在两个潜在问题:DNA必须先穿过细胞膜,然后再进入细胞核,然后再在细胞核中被转录为mRNA。转录完成后,细胞核中的mRNA被转运至细胞质,然后细胞质中的细胞翻译相关物质启动合成相应蛋白抗原。mRNA疫苗则不需经过这些繁琐过程,它们可直接在细胞质完成翻译。(参见下图mRNA疫苗工作原理)因此mRNA疫苗给药剂量也很小:与同等DNA疫苗相比,剂量低1,000多倍(2)。
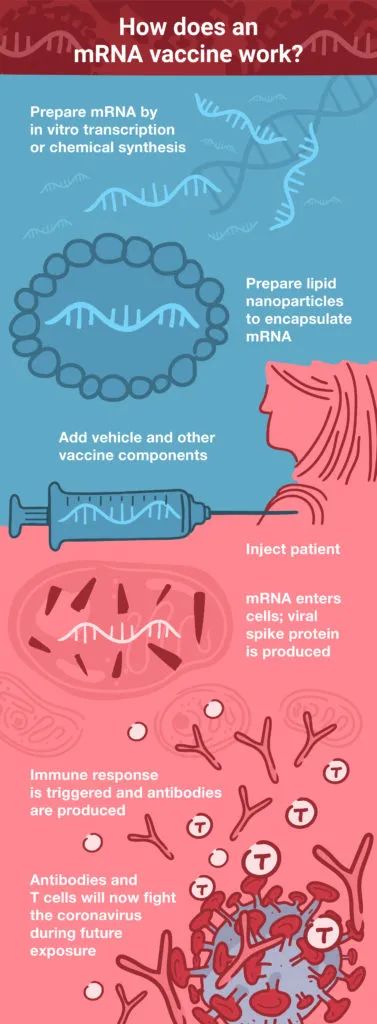
DNA疫苗早期开发阶段应关注的一个问题便是外源DNA是否可整合至宿主基因组中。虽然随着DNA病毒载体开发取得一定进展,此问题已部分得到解决。但与DNA相比,无需进入细胞核且细胞内半衰期很短的mRNA疫苗基本无此问题。
但是,RNA疫苗也存在其缺点。首先,RNA的稳定性比DNA差。这便是为何mRNA疫苗制剂对冷链运输条件和储存条件均有一定要求:辉瑞/BioNTech疫苗应于干冰(–80°C)条件下运输,而Moderna疫苗则仅需在更易控制的–20°C条件下(使用凝胶包)。疫苗接收后,可将其置于常规冰箱中短期储存。
RNA注入人体后,还存在另一个问题。人类机体细胞存在可摧毁外源、不受保护或“裸露”RNA的精细防御机制。但是,可通过在合成过程中对RNA进行修饰,从而降低mRNA降解的可能性。其中一种修饰方式为添加与RNA(A、U、C和G)正常核苷类似的核苷类似物(引起的结构变化较小),从而提高RNA对核糖核酸酶降解的抵抗力。其他结构修饰和插入调控序列等方式也可改善mRNA的稳定性(6)。
最后,可将mRNA与脂质纳米颗粒制成复合物进行给药,从而提高mRNA的稳定性、使之更易进入细胞和增加每一细胞内的抗原产生量(7)。与裸露mRNA相比,脂质纳米颗粒制剂引起的免疫应答更为强烈(8)。
在DNA疫苗研发过程中,DNA成功到达细胞内的细胞核后,单个DNA模板便可产生大量mRNA。与mRNA疫苗相比,每一细胞内的抗原产生量更高。生产自我扩增mRNA疫苗的最新方法可克服这一缺点(9)。由于尚未公布相关mRNA结构的详细信息,因此尚不明确辉瑞/BioNTech疫苗或Moderna疫苗是否采用了该技术。
近期公布的冠状病毒疫苗给恢复正常生活带来了更多希望。但是,有效的疫苗仅是全面大流行应对策略的一部分。目前我们亟需开发出有效治疗药物用以治疗已感染人群。与此同时,戴好口罩和保持社交距离等降低感染风险的措施仍是抵御疾病的第一道防线。
相关产品
点击以下产品名称可查看产品详情
相关资源
Promega针对病毒研究和疫苗研发的相关资源
参考文献
1. The complex journey of a vaccine. International Federation of Pharmaceutical Manufacturers & Associations (IFPMA). [www.ifpma.org/resource-centre/the-complex-journey-of-a-vaccine-final/;last accessed November 24, 2020]
2. Rachlin, E. and Watson, M. (2017) White paper: mRNA vaccines: disruptive innovation in vaccination. Moderna Therapeutics. [www.modernatx.com; last accessed November 24, 2020]
3. Wolff, J.A. et al. (1990) Direct gene transfer into mouse muscle in vivo. Science 247 (4949), 1465–1468.
4. MacGregor, R.R. et al. (1998) First human trial of a DNA-based vaccine for treatment of human immunodeficiency virus type 1 infection: safety and host response. J. Infect. Dis. 178(1), 92–100.
5. Rauch, S. et al. (2018) New vaccine technologies to combat outbreak situations. Front. Immunol. 9, 1963.
6. Holtkamp, S. et al. (2006) Modification of antigen-encoding RNA increases stability, translational efficacy, and T‑cell stimulatory capacity of dendritic cells. Blood 108, 4009–4017.
7. Geall, A.J. et al. (2012) Nonviral delivery of self-amplifying RNA vaccines. Proc. Natl Acad. Sci. USA 109, 14604–14609.
8. Lutz J. et al. (2017) Unmodified mRNA in LNPs constitutes a competitive technology for prophylactic vaccines. NPJ Vaccines (2017) 2, 29.
9. Fuller, D.H. and Berglund, P. (2020) Amplifying RNA vaccine development. N. Engl. J. Med. 382, 25.
END

普洛麦格(北京)生物技术有限公司
Promega (Beijing) Biotech Co., Ltd
地址:北京市东城区北三环东路36号
环球贸易中心B座907-909
电话:010-58256268
网址:www.promega.com
技术支持电话:400 810 8133(手机拨打)
技术支持邮箱:chinatechserv@promega.com





