关键词:G蛋白偶联受体(GPCR),生物发光检测,活细胞动态监测,GPCR内化,GPCR互作,第二信使cAMP检测。
快速了解本篇文章介绍重点。
要点概述
Promega用于监测GPCR药理学的技术与测定方法:
● NanoBiT®平台
• 小标签最大限度地减少了对融合伴侣生物活性的干扰
• 明亮的生物发光提供了极高的灵敏度,例如在内源性表达水平上进行检测
● 监测配体诱导的内化作用
• GPCR内化和循环利用的定量
• 动力学与终点法分析
● 监测GPCR与β-arrestin-2的相互作用
• 简单的操作流程,强大的信号背景比(S:B)
● cAMP的实时与终点法检测
● 基于细胞的均质型测定方法
• 适用于自动化和高通量筛选
基本介绍
G蛋白偶联受体(GPCRs)一直是新型治疗药物的关键靶标。为了支持这些研究工作,我们开发了一套生物发光检测方法,能够在活细胞中实时研究GPCR的动力学。受体内化和循环过程的量化是基于对受体N端进行HiBiT (一个11个氨基酸的肽段)的融合。HiBiT能以高亲和力与LgBiT结合,形成NanoBiT®萤光素酶。之后加入一种非裂解性检测试剂,其中包含不可透膜的LgBiT和furimazine底物。通过对HiBiT标记的GPCRs在细胞表面密度变化的实时监测,来跟踪受体的内化和循环过程。值得注意的是,NanoBiT®萤光素酶发出的强烈信号使得我们能够利用CRISPR/Cas9技术引入HiBiT标签,在内源性表达水平上进行实验。类似地,将LgBiT和SmBiT(另一个对LgBiT有低亲和力结合的11个氨基酸肽段)分别形成融合蛋白可用于实时检测激活的GPCRs对β-arrestin-1/2的招募。此外,通过使用热稳定型或环化突变形式的萤光素酶,可在终点法(cAMP-Glo)或实时检测模式(GloSensor cAMP)下,灵敏地测定细胞内cAMP浓度的变化。这些均质的、基于细胞的检测方法易于适应实验室自动化操作,对于GPCR药理学研究具有极大的价值。
NanoLuc®二亚单元技术(NanoBiT®)
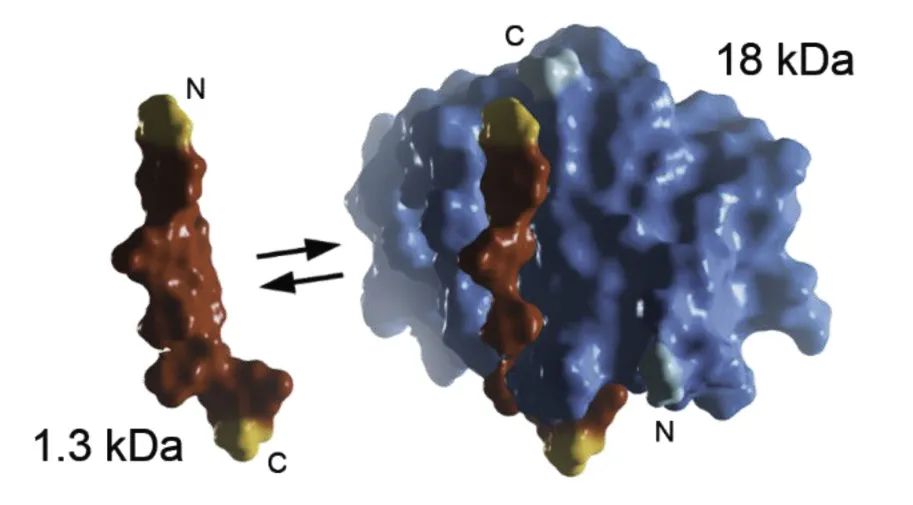
● NanoLuc®在91个不同的位点被分割成两个亚基。
● 位于156/157之间的位点因其自身聚集作用微弱而被选中。
● 大亚基(LgBiT)显著提高了稳定性、表达水平和亮度。
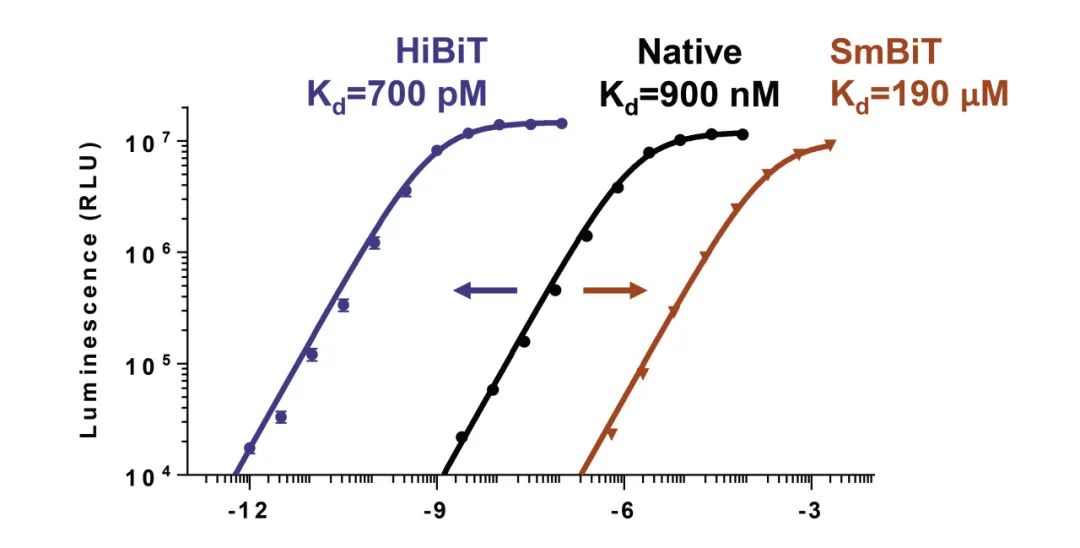
● 已鉴定出具有广泛亲和力范围(超过5个数量级)的小肽段文库。
• SmBiT ——亲和力最低,用于蛋白质:蛋白质相互作用检测。
• HiBiT ——亲和力最高,作为检测用标签。
Dixon, A., et al., ACS Chem. Bio. 2015
应用数据展示
01
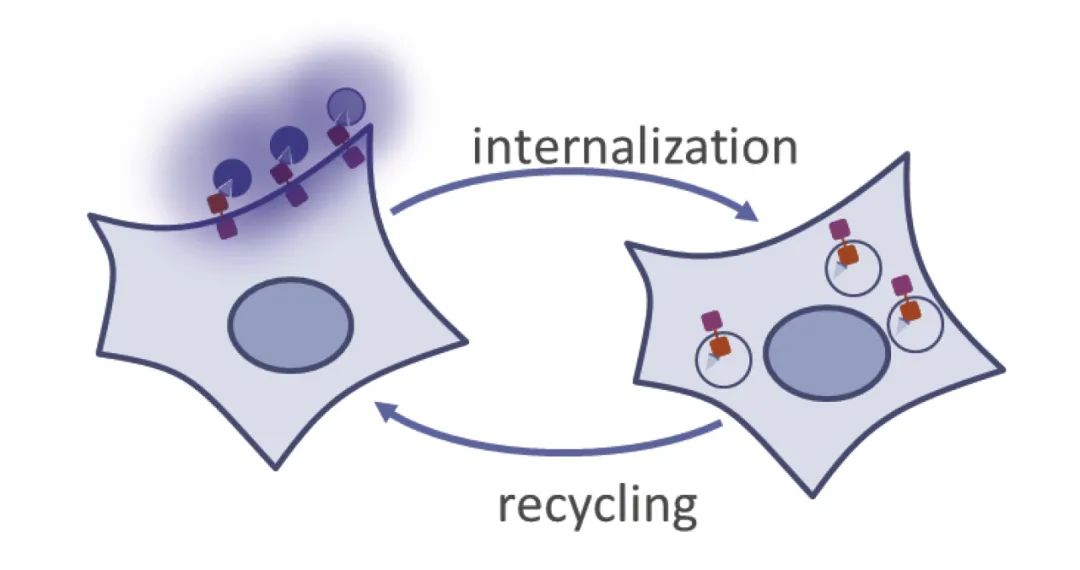
使用HiBiT监测GPCR的内化和循环
HiBiT标记技术
● 小标签:仅具有11个氨基酸;
● 高灵敏度:
• 与LgBiT高亲和力互补时产生明亮的生物发光
• 允许在内源性表达水平上进行分析
● 可选择性进行细胞表面检测:得益于LgBiT的细胞非透膜性;
● 简化的CRISPR/Cas9敲入流程:减少人工干扰。
监测内吞与回收过程
● 定量:测定HiBiT-GPCR细胞表面密度的变化
● 简单:添加-读数检测法,在4分钟内即可定量表面表达
● 动力学:非裂解型检测,实时动态检测
02
配体诱导的β2-肾上腺素受体(β2-AR)内化与循环
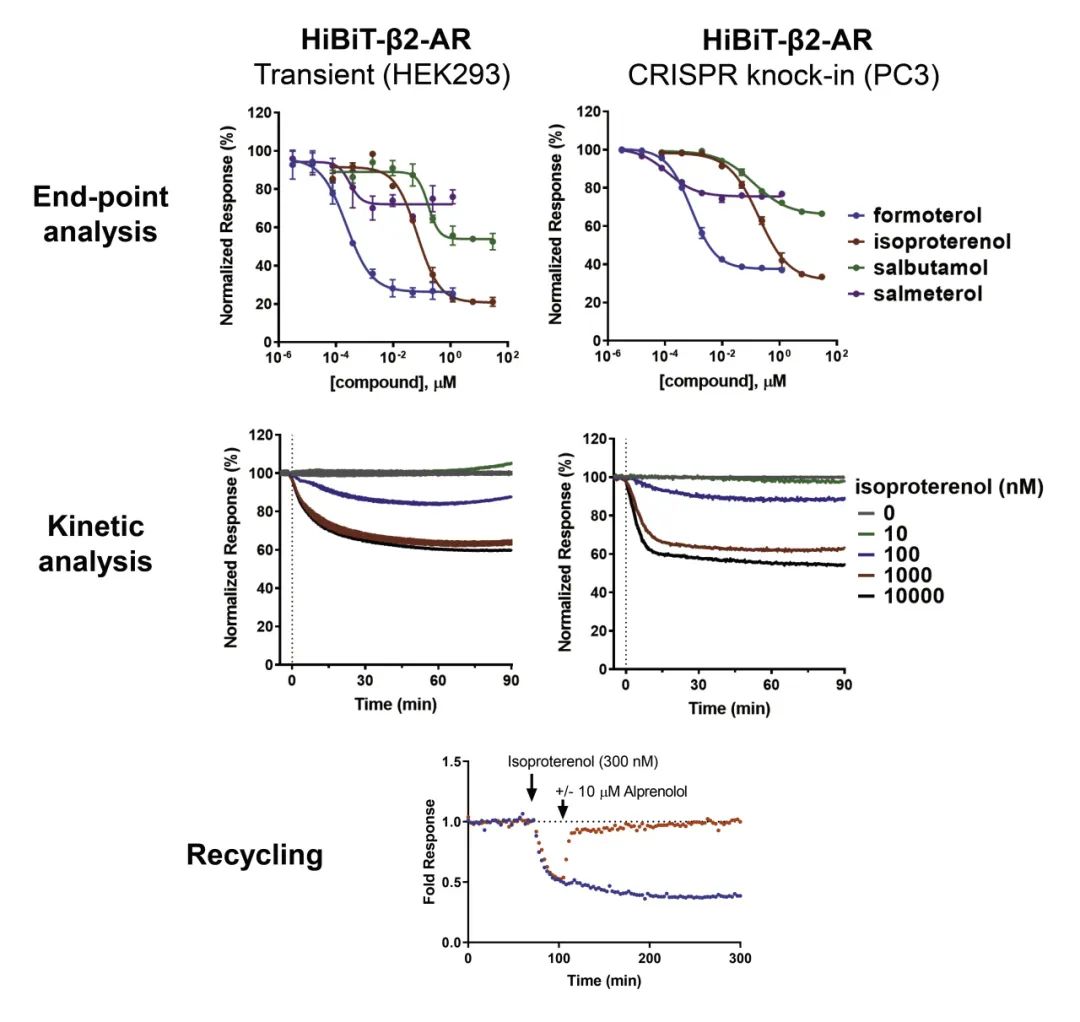
● 使用不同配基研究β2-AR内化作用,与已报告的值总体一致;
● 实时监测受体的内化与循环过程。
03
使用NanoBiT®双向载体系统(BiBiT)测定β- Arrestin-GPCR相互作用
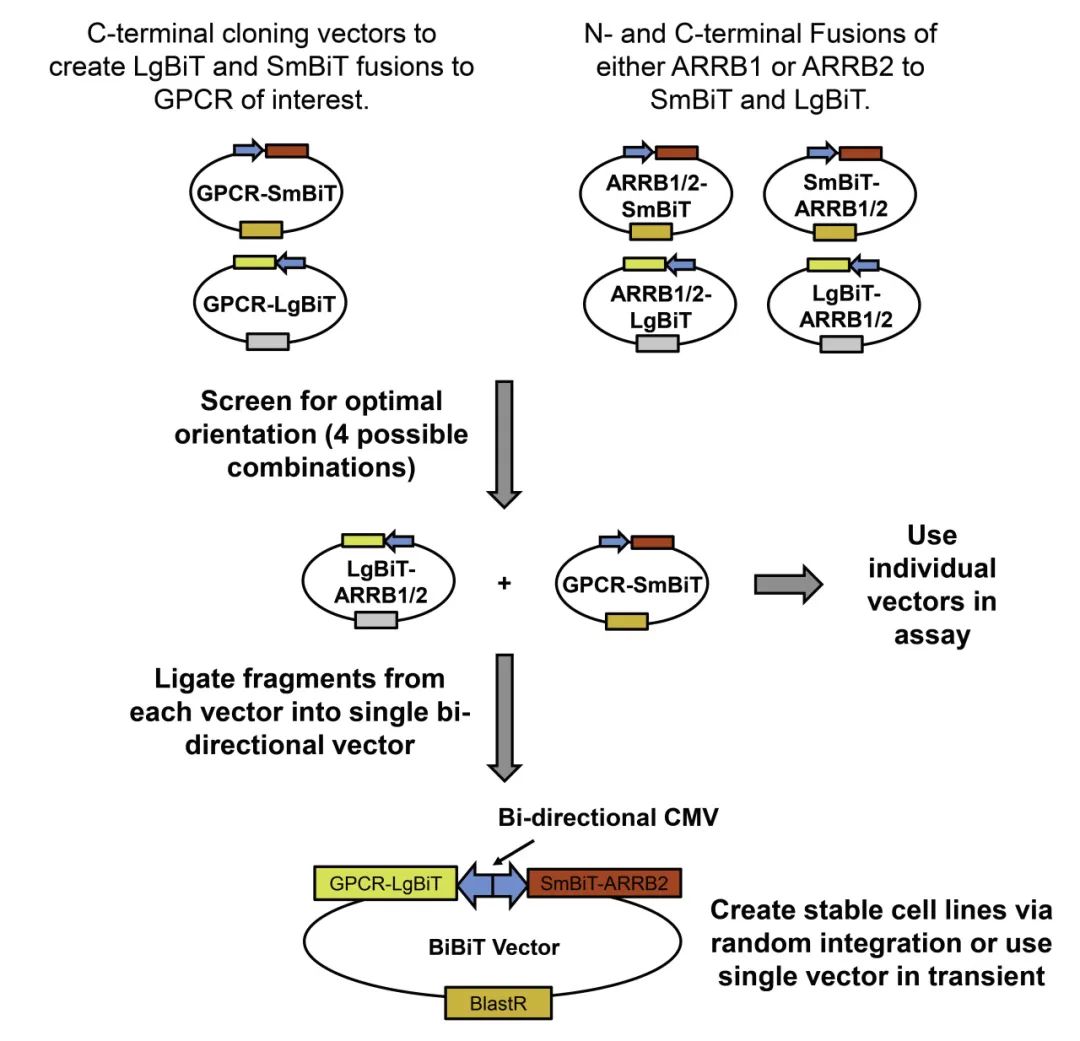
● 使用单独的抗性基因或BiBiT方法构建稳定的细胞系;
● SmBiT与LgBiT的互补依赖于β-Arrestin-GPCR的相互作用。
04
实时监测β-Arrestin2相互作用
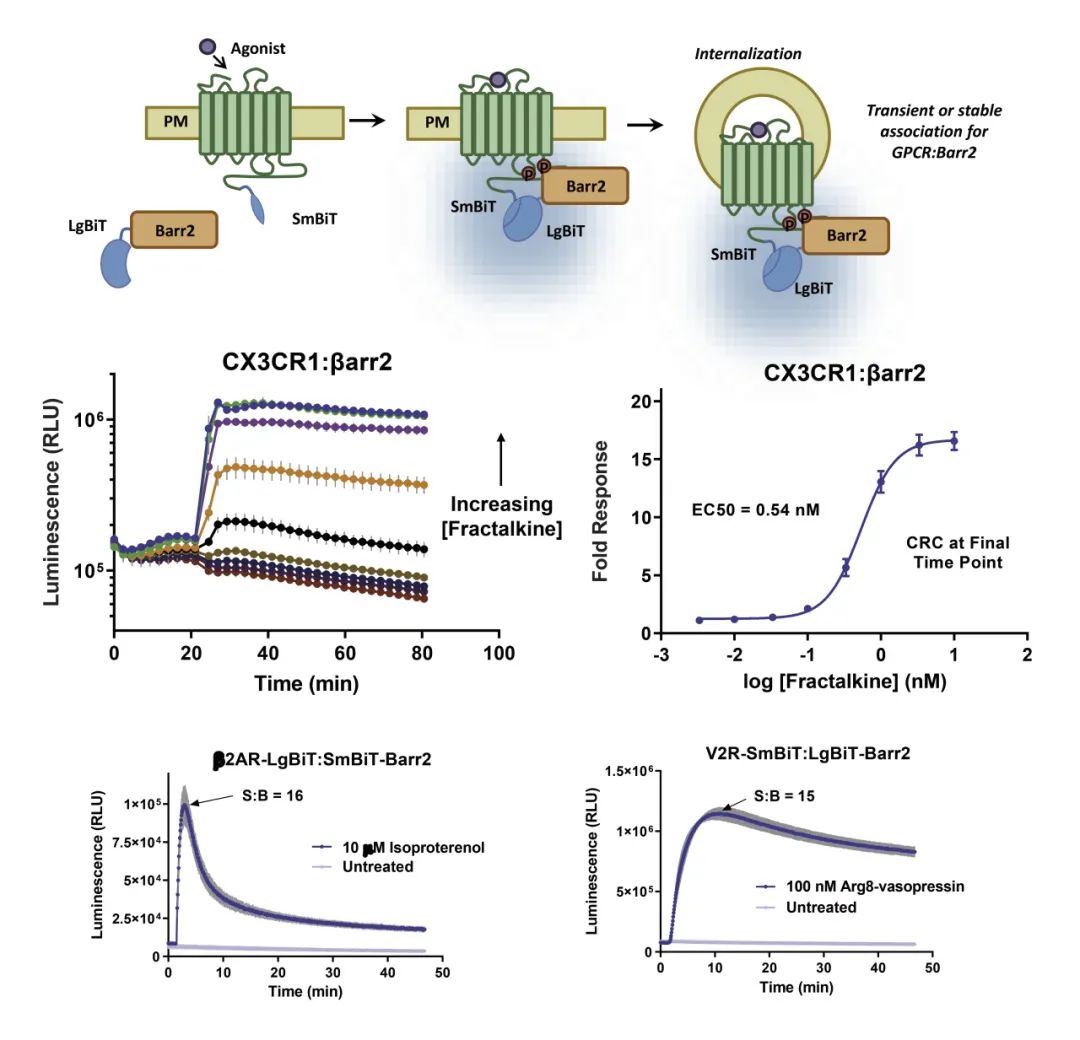
● 实时监测GPCR与β-arrestin-1/2的相互作用;
● 低表达水平下检测相互作用。
05
实时检测CX3CR1:β-arrestin-2相互作用
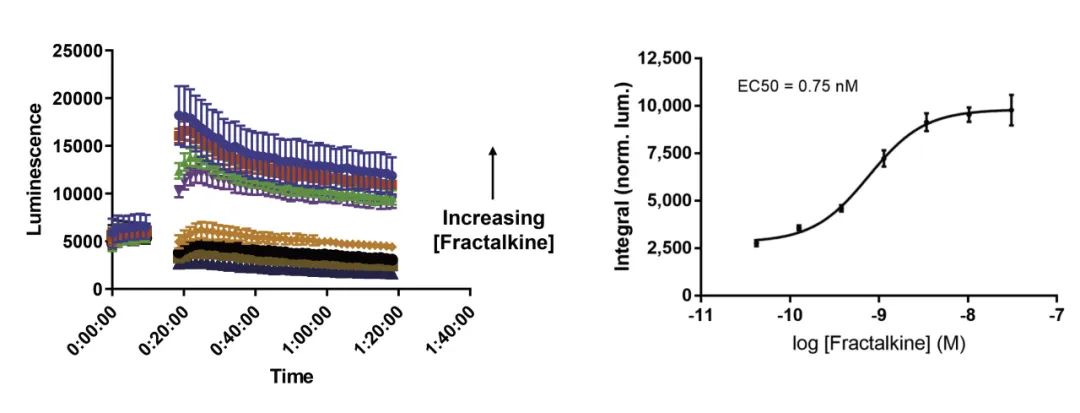
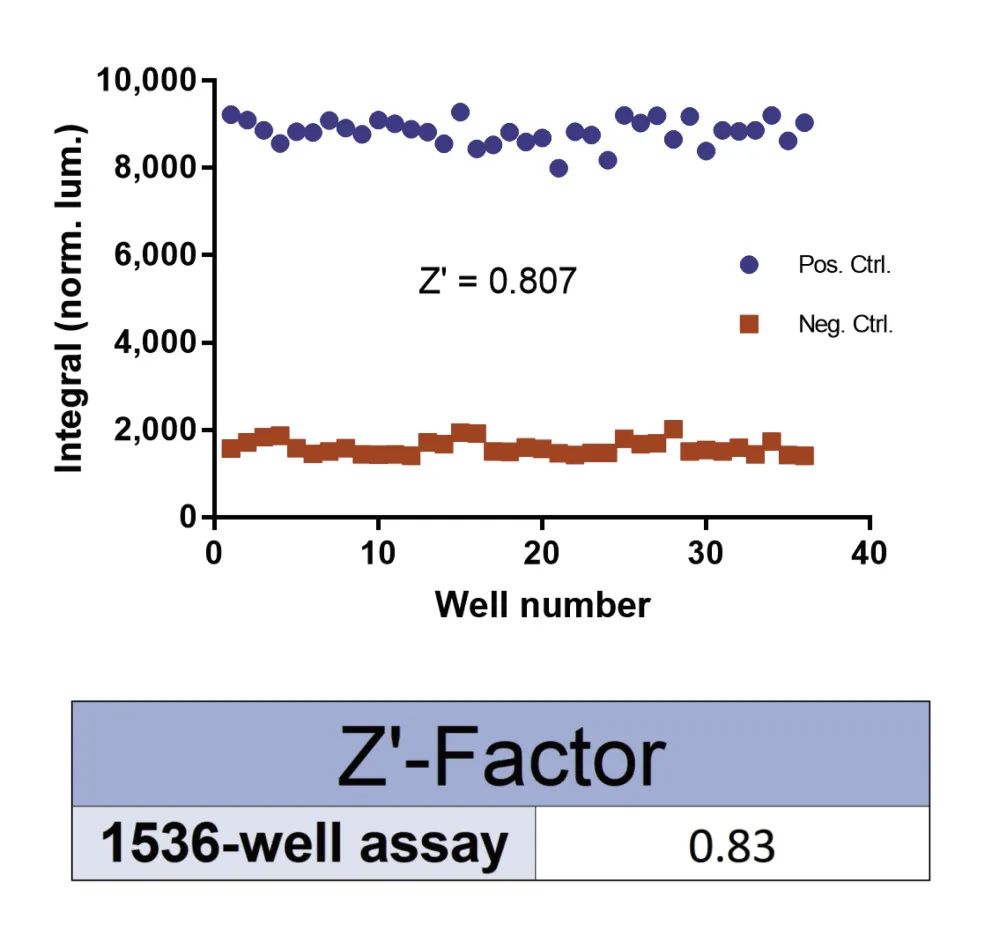
● 该方法在1536孔固体白色微孔板中运行。
● Z'因子从36次重复测量中计算得出 。
● 具有低变异性、稳健的测定方法
06
cAMP的实时与终点检测方法
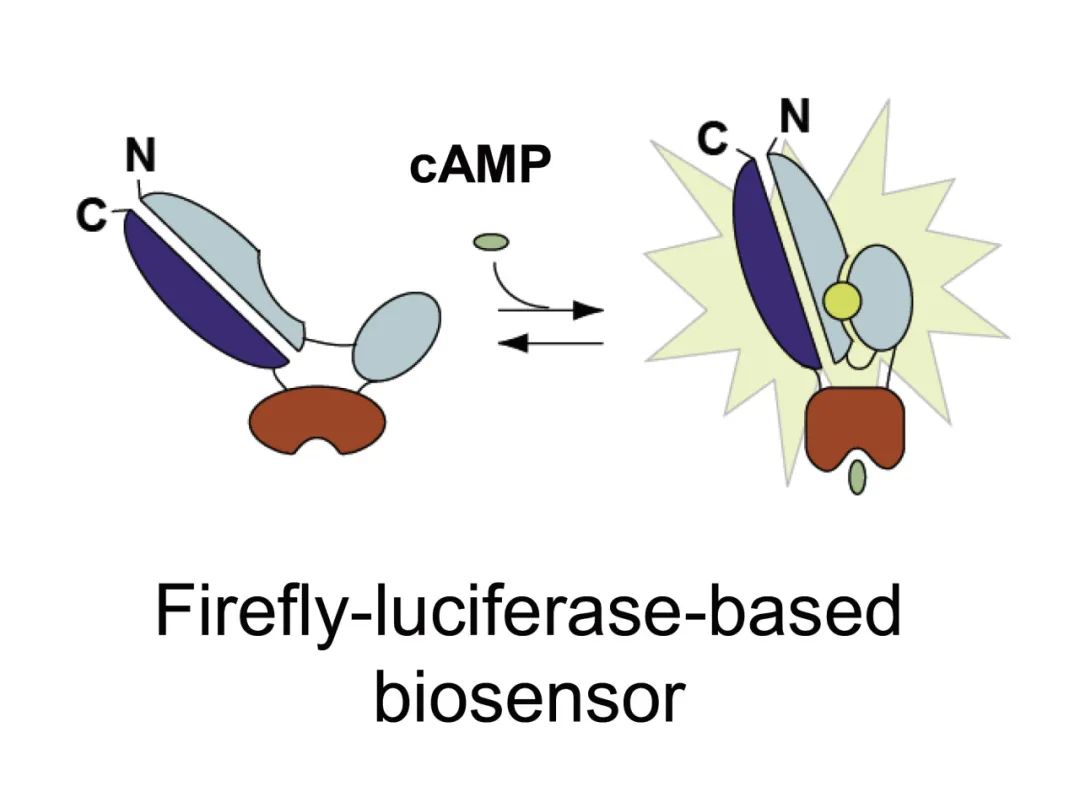
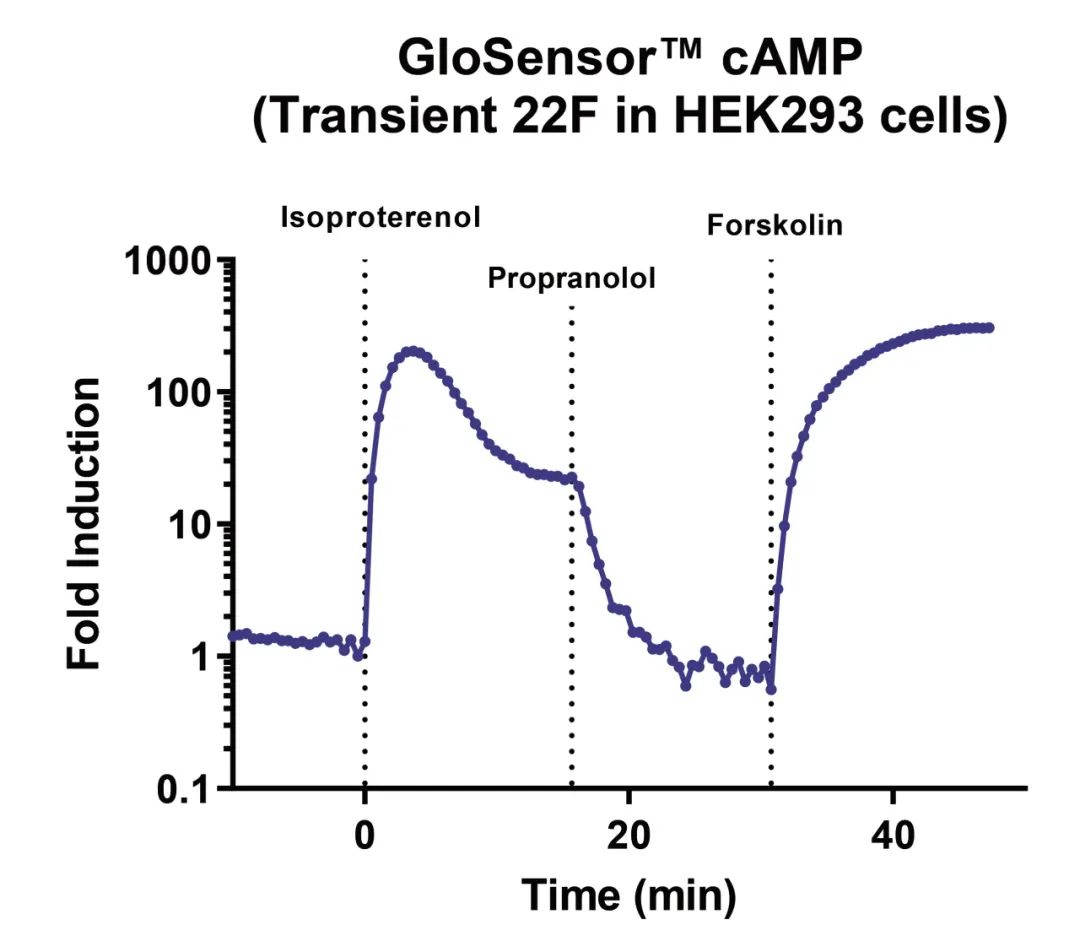
● 实时监测细胞内[cAMP]的变化
● 具有宽广动态范围的高灵敏度检测方法
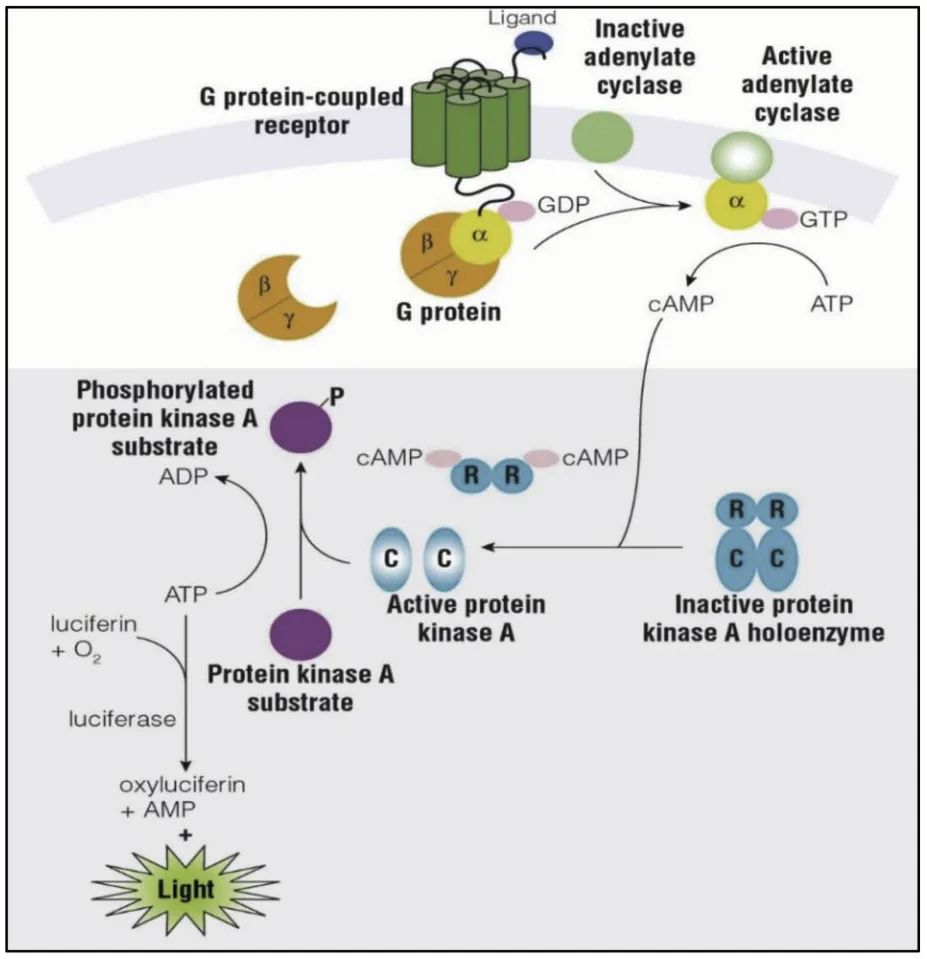
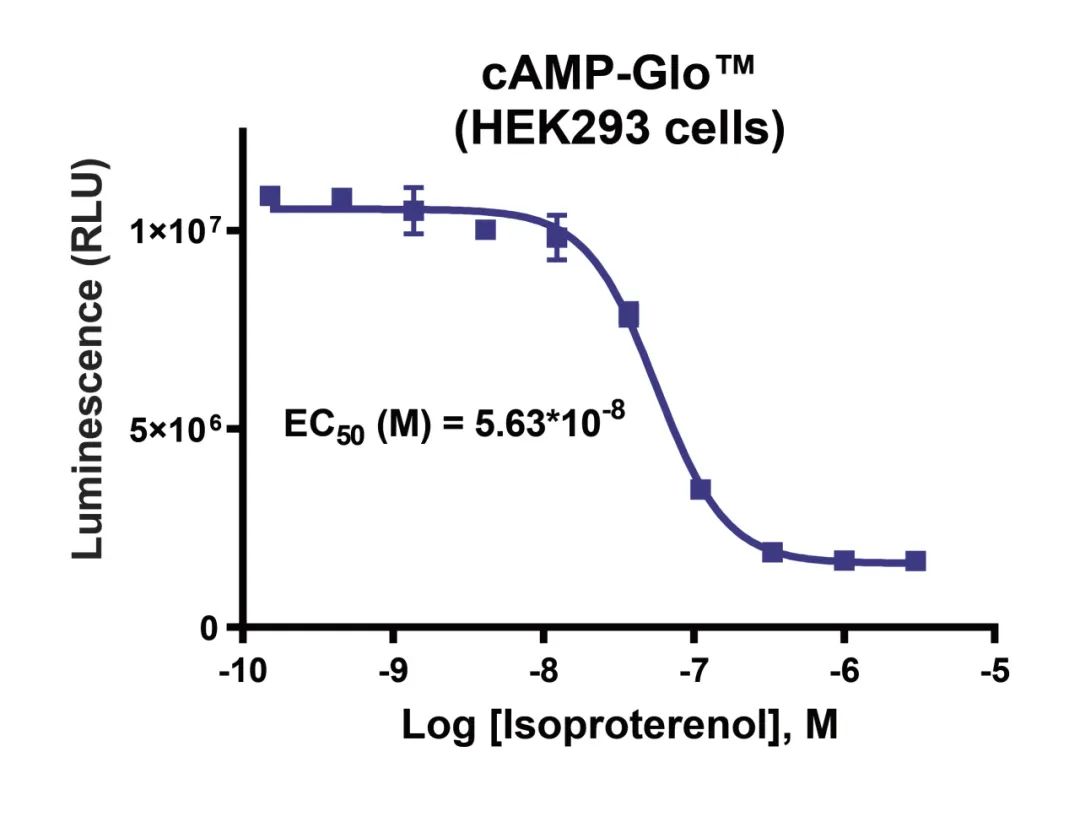
● 对裂解物中[cAMP]变化进行灵敏地终点法检测
技术资源
GPCR信号通路研究工具

HiBiT蛋白标签系统

蛋白相互作用研究解决方案

NanoBiT®蛋白互作研究


产品信息

说明书查询

实验工具

技术资料









