Promega可为您提供多种检测试剂盒和先进技术来助力RAS药物的研发。这些检测试剂盒可检测化合物与通路组分的结合,并评估它们对蛋白质相互作用、蛋白质水平以及最终ERK激活的影响。
与GTP结合的活化的Ras,激活RAF,RAF激活后磷酸化MEK并激活MEK,活化的MEK再进行ERK的磷酸化和激活。
- RAS:包括KRAS、HRAS和NRAS在内的小型GTP酶家族
- RAF:由c-Raf、B-Raf和A-Raf组成的丝氨酸/苏氨酸激酶家族
- MEK:丝裂原活化蛋白激酶(MAPK/ERK 激酶)
- ERK:细胞外信号调节激酶家族,也称为丝裂原活化蛋白激酶(MAPK),由具有约85%序列一致性的ERK1和ERK2组成

靶点相互作用
NanoBRET™技术提供了灵敏、高特异性的方法来检测小分子药物与其靶蛋白在活细胞中的相互作用。使用NanoBRET™ Target Engagement Assay,您可以:
- 定量检测活细胞中的化合物亲和力(与蛋白质结合的紧密程度)以及目标蛋白的占有率(与蛋白质结合的量)。
- 评估化合物在生理条件下与目标蛋白结合的时间(其停留时间)。
- 扩展简单、多孔的检测,以满足您的研究通量需求。
- 生成具有低错误率和高重现性的高质量数据。
- 可使用即用型检测试剂盒快速入门。
 |  |
| NanoBRET™ Target EngagementAssay的技术原理。 | ERK2靶点结合检测。对指定的化合物进行滴定以检测活细胞中ERK2融合蛋白的占有率。 |
我们开发了一种 pan-KRASNanoBRET™示踪剂,它能够在这个具有挑战性的KRAS靶点(以前被认为是不可成药的靶点)上检测各种正构和变构作用机制。
请联系我们以了解有关pan-KRAS检测的更多信息。

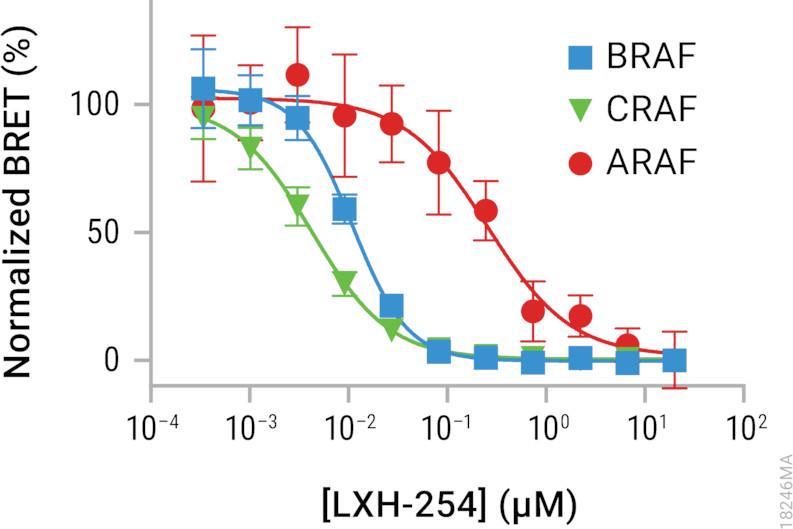
有关BRAF, CRAF或ARAF启动子特异性检测的问题请联系我们!
阅读更多关于KRAS的靶标相互作用检测
这篇发表在《Nature Chemical Biology》上的文章中,我们研究了KRAS小分子抑制剂的可逆结合,以评估哪些热点突变体易受细胞中switch-II pocket(SII-P)结合的影响。我们发现许多KRAS热点突变体的SII-Ps可以通过非共价配体与之结合。我们的结果强调SII-P是KRAS上的一个特殊药物结合位点,揭示了RAS驱动癌症的新的治疗机会。 点击右图查看原文。

 | |
| 利用HiBiT: LgBiT互补研究细胞内的蛋白质降解的原理图。 | 延时活细胞成像。将CRISPR-HiBiT BRD4细胞用MZ1(一种BET溴结构域降解剂)处理。在2小时内观察到BRD4的均匀损失。使用Olympus LV200 系统进行成像。 |
蛋白降解中HiBiT的使用
HiBiT是研究内源性蛋白质的常用标签。HiBiT是含有11个氨基酸的小肽,可与称为LgBiT的大亚基以高亲和力结合。结合形成的复合物具有高萤光素酶活性,在添加底物的情况下会产生明亮的发光信号。与较大的标签相比,HiBiT的小分子量可以更加高效地敲入基因,而无需分子克隆步骤,这也使其非常适合CRISPR/Cas9基因编辑工作流程。

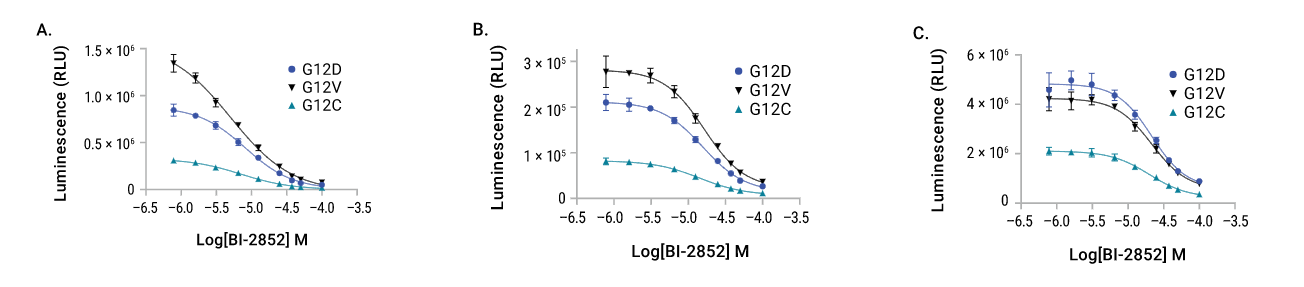
PROTAC处理后内源性HiBiT-KRasG12C的活细胞降解动力学。A. HiBiT通过CRISPR/Cas9插入到MIA-PaCa2细胞系内源性KRasG12C基因座的N端。在LgBiT表达后,使用基于VHL的KRasG12C PROTAC:LC-2,在含Nano-Glo®Endurazine™底物的培养液中(CO2非依赖性)进行剂量响应动力学降解实验。RLU是相对于DMSO对照绘制的。B. 在MIA-Paca2细胞中使用亲本抑制剂MRTX849对HiBiT-KRasG12C进行了类似的活细胞发光研究,在相同的剂量反应处理中,没有显示KRasG12C的损失。
1. NanoBRET™技术
NanoBRET™技术能够灵敏、可重复地检测天然细胞环境中的蛋白质-蛋白质相互作用(PPI)。使用低水平表达的全长蛋白质能够进行PPI的监测和筛选研究,而这些研究可以反映真实的细胞生理学水平。与传统BRET检测相比,明亮的蓝移供体信号和红移受体可产生最佳的光谱重叠、信号增加且背景干扰较低。
NanoBRET PPI检测的基本原理。
| NanoBRET™技术文章: Machleidt, T.et al.(2015) NanoBRET—A novel BRET platform for the analysis of protein–protein interactions. ACS Chem.Biol. 10(8), 1797–1804. |

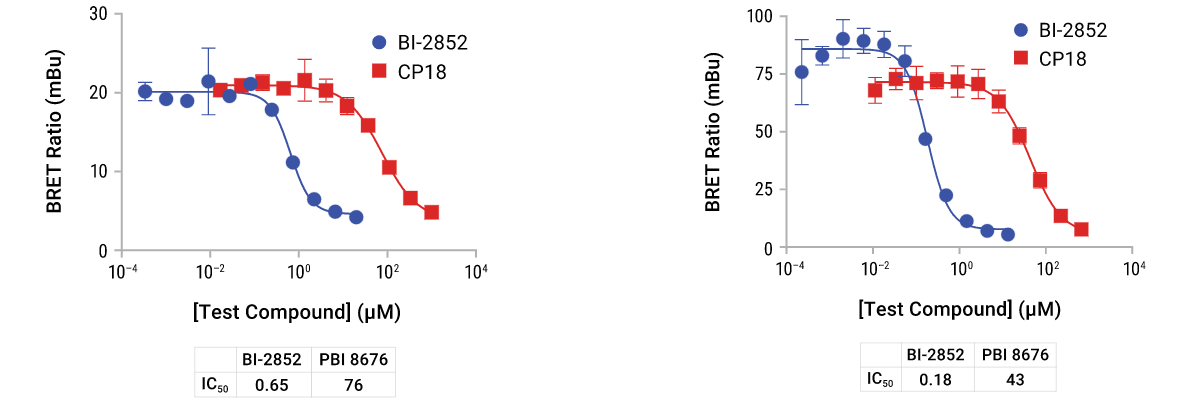
NanoBRET™检测可涵盖RAS和RAF基因家族成员,用于研究通路中蛋白质相互作用的抑制和/或诱导。RAS:RAF检测动力学 +/-BI-2852抑制剂(左图);RAF二聚化检测显示GDC0879的诱导(右图)。

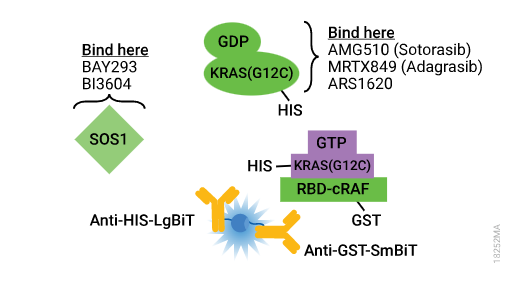
抑制KRAS WT:SOS1cat结构域相互作用。通过BI-3406和BAY-293的剂量响应处理,SOS1的催化结构域与KRAS WT分离。
2. NanoBiT®技术
NanoLuc® Binary Technology(NanoBiT)是一种基于NanoLuc®萤光素酶的二亚基系统,可用于活细胞中PPI的细胞内检测。这个简短的视频阐明了该技术的作用原理。

相关资源:
- 想了解有关使用NanoBiT®技术研究参与RAS通路的PPI的更多信息,请点击此处。
- 如需了解更多关于使用NanoBiT®技术研究RAS信号通路中的蛋白相互作用, 可点击此处下载PPT, 其中展示了来自野生型和突变型KRAS与CRAF 或 BRAF结合的数据。
- NanoBiT® 技术文章: Dixon, A. S. et al. (2016). NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells. ACS Chemical Biology. p. 400-408
数据展示:

EGF处理后,实时监测在血清饥饿的HeLa细胞中KRAS 4B (野生型):CRAF (全长)相互作用。
Promega可提供一系列NanoLuc®, HaloTag®, NanoBiT® and NanoBRET载体帮助您开始您的蛋白互作研究。点击下方按钮查看所有可用于检测活细胞中RAS通路相互作用的检测方法。
3. 检测带标签蛋白的相互作用

 |  |
 | 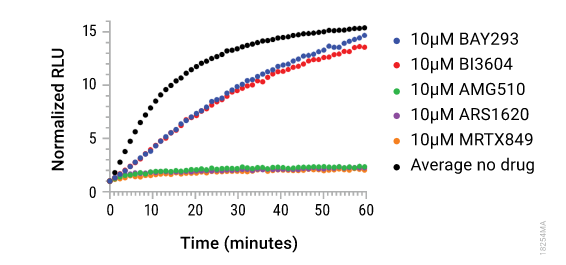 |
| Lumit™KRAS- KRAF检测可用于测定KRAS突变体小分子抑制剂的特异性。 | KRAS的激活周期可以在体外重建,并且在小分子抑制剂存在下可以监测KRAS/cRAF结合的动力学,作为SOS1介导的GDP/GTP交换的响应。 |
Swiatnicki, M. et al. (2022) Profiling oncogenic KRAS mutant drugs with a cell-based Lumit p-ERK immunoassay. SLAS Discovery. p 249-247.
您可以通过以下文章了解更多关于使用 Lumit™ p-ERK Immunoassay 研究KRAS的应用:


RAS突变体抑制剂。Lumit™检测显示了KRAS单点突变抑制剂对细胞p-ERK的抑制作用。在MCF-7 (WT)、SW620 (G12V突变体)、Mia-PaCa-2 (G12C突变体)、AsPC-1 (G12D突变体)中进行多种KRAS突变抑制剂的滴定,并使用Lumit™p-ERK检测KRAS的抑制。图A-C. p-ERK Lumit™检测显示KRAS G12C化合物具有高选择性,对Mia-PaCa-2细胞具有完全抑制作用,对KRAS WT、G12D和G12V细胞无抑制作用。图D. Lumit™检测显示,MRTX-1133对KRAS G12D具有很强的选择性,在较高的IC50s下对KRAS G12C和G12V有一定的混杂性。
更多相关信息,请参阅应用说明或访问Lumit™ Immunoassay Cellular System产品页面。
GTPase
GTPase-Glo™ Assay可分析GTPase、GAP激活的GTPase、GAP和GEF的内在活性。该方法测定了GTPase反应后剩余的GTP,检测试剂将GTP转化为ATP,然后对生成的ATP进行生物发光检测。
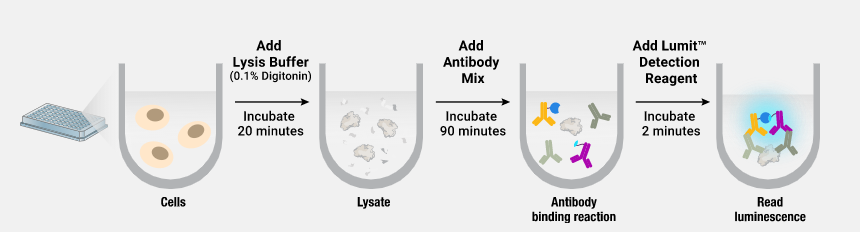
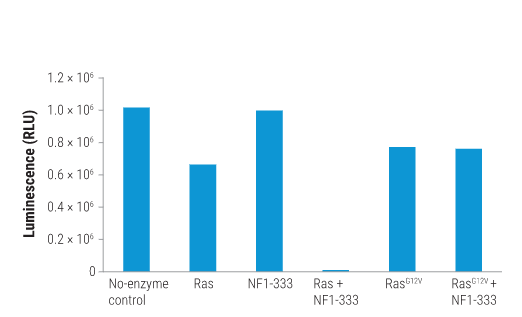
Ras和NF1-333的GTPase活性和GAP介导的GTPase活性。用2μM野生型或突变型Ras、1μM NF1-333和5μM GTP在含有1mM DTT的GTPase/GAP缓冲液中组装反应体系,最终反应体积为10μL。将该反应溶液在室温下孵育90分钟。之后加入10μL GTPase-Glo™ Reagent 并在室温下孵育30分钟。添加检测试剂(20µL),将培养板在室温下孵育5-10分钟,并使用 GloMax® Discover System记录发光信号。

GTPase-Glo™ Assay的作用原理。
点击此处,了解更多信息,或访问GTPase-Glo™ Assay产品页面。







