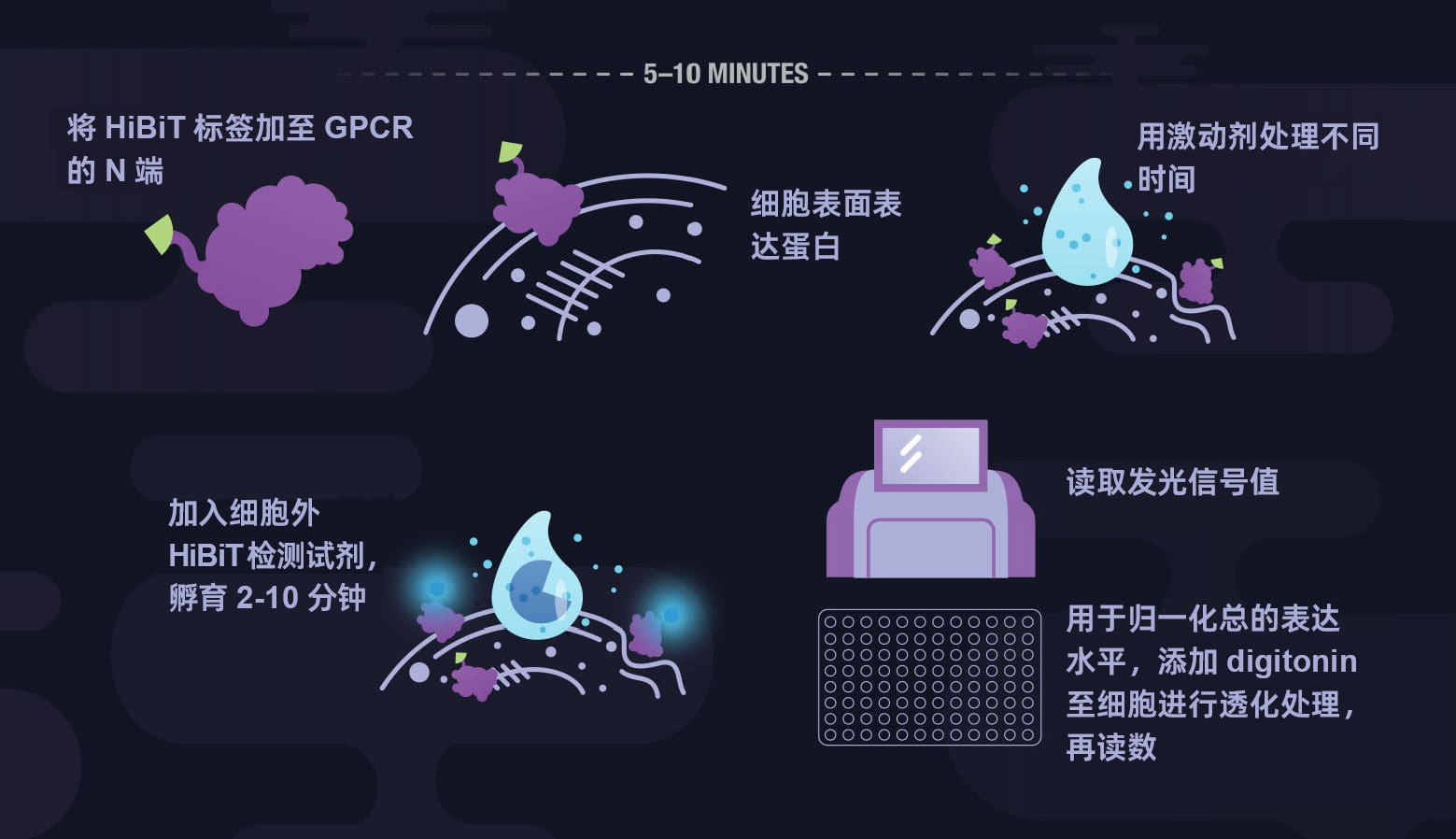
HiBiT蛋白标签系统
用简单的发光信号检测和定量标签标记任意蛋白。
HiBiT简化了蛋白质检测,通过使用一种方便的基于生物发光的方法为检测标签化蛋白提供了一种改进的替代方法。HiBiT技术无需过表达即可检测蛋白质的动态范围,单种试剂添加更方便,还能进行活细胞检测,为研究蛋白质生物学的研究人员提供了更多的可能性。兼容灵敏的和特异性的抗HiBiT单克隆抗体,扩充了HiBiT标签蛋白的检测,使传统的基于抗体的方法可以检测HiBiT标签。
- HiBiT标签蛋白体积小,只有11个氨基酸,对所研究蛋白影响小
- Promega提供多种类型HiBiT标签检测系统
- HiBiT检测线性范围宽,>7个数量级,可检测低至10-18摩尔(amole)的蛋白
- 商品化HiBiT载体,可以快速将HiBiT标签与感兴趣蛋白构建融合蛋白载体
- 可应用CRISPR 技术将HiBiT标签整合到目标蛋白基因组相应位置,而无需克隆,在蛋白内源表达水平上研究
- 可简化传统Western blot 实验操作流程,无需抗体
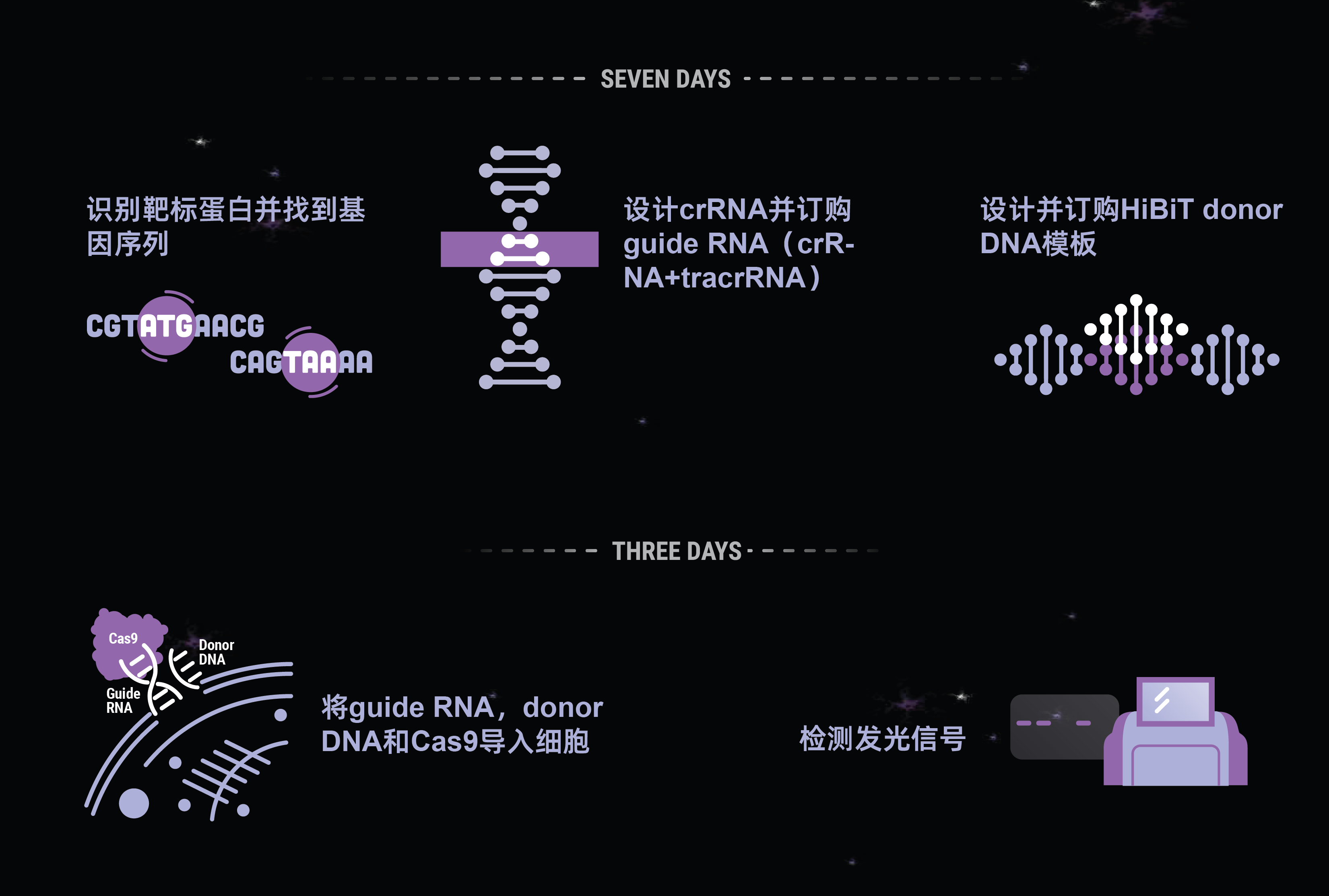
通过CRISPR敲入标记内源蛋白-无需克隆
HiBiT技术通过消除插入前的分子克隆需求和简化标签蛋白的检测流程,使CRISPR介导的标签敲入成为可能。由于HiBiT标签很小,使得CRISPR插入效率高,而且生物发光使无抗体检测也具有检测内源性表达的灵敏度。
HiBiT技术应用举例——监测受体内化
HiBiT检测方法消除了受体内化研究中基于抗体检测的必要。使用HiBiT技术,操作流程中去除了多个抗体结合步骤和相关的洗涤步骤。只需加入检测试剂,即可测量出发光信号。
HiBiT技术应用举例——定量蛋白丰度和降解
经典的表位标记方法在通量或灵敏度上是有限的,要求使用高质量的抗体,但也可能只产生半定量的结果。HiBiT标签将生物发光的简便性和灵敏度引入到蛋白质丰度的研究中,可对内源性水平的蛋白质进行定量,即使是那些维持在低表达水平的蛋白质。

HiBiT技术应用举例——快速简单的免疫印迹
HiBiT印迹系统是一种灵敏、快速的检测方法,可以替代费时费力的免疫印迹技术,且无需抗体。
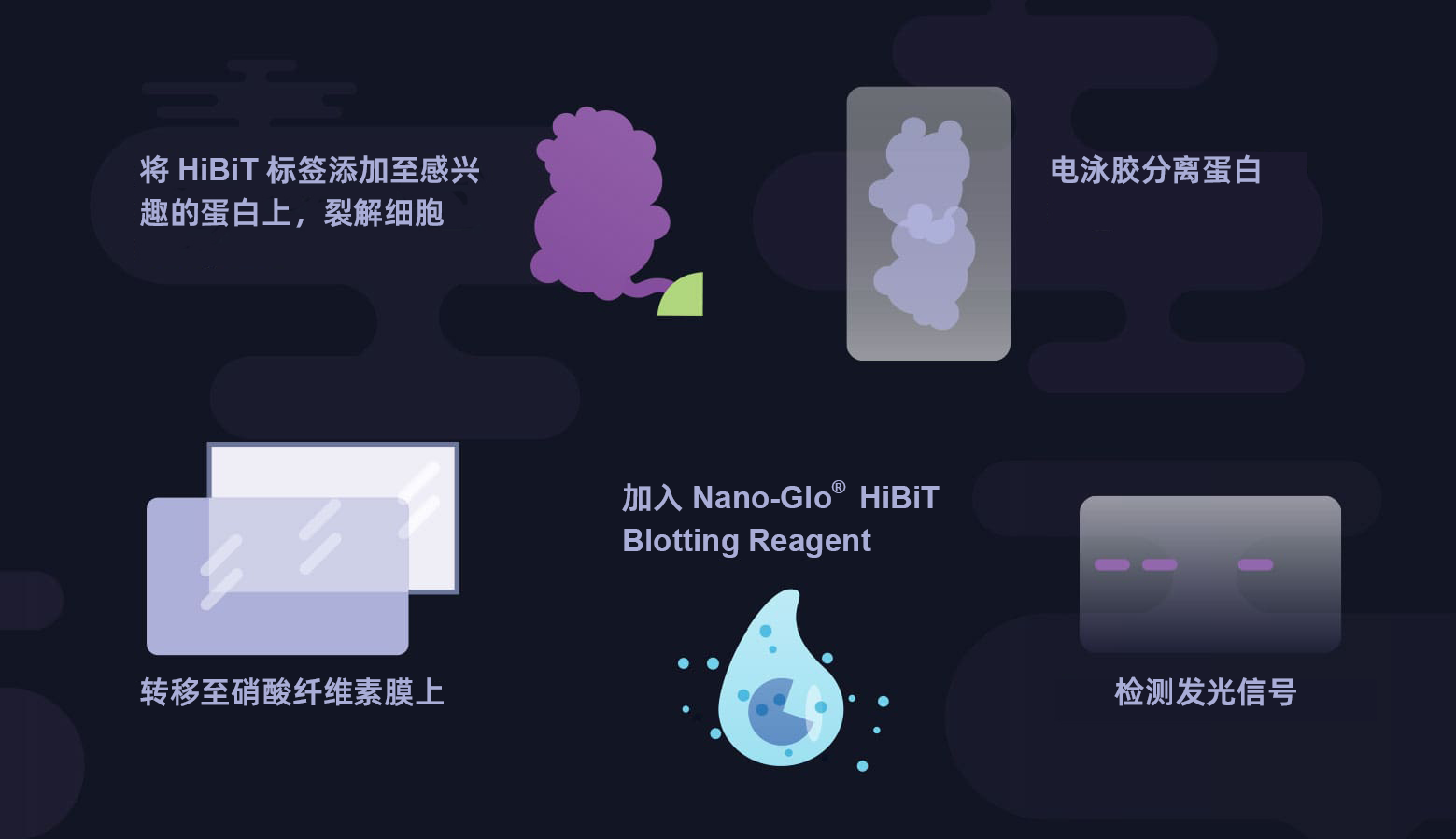
1. 什么是HiBiT印迹检测?
- HiBiT印迹检测:一种快速、灵敏的Western Blot替代方法
- 5分钟内出结果
- 无需抗体
- 背景低,灵敏度高
- 无需洗涤或封闭步骤
HiBiT是一种基于蛋白质互补的生物发光检测方法。HiBiT标签被添加到你感兴趣的蛋白质中,当互补的LgBiT亚基与HiBiT结合时,形成一个具有功能性的萤光素酶进行检测。

2. HiBiT与传统的表位标签不同
- 在传统的Western blotting中,你需要一个目标蛋白或表位标签的抗体,以及一个检测该种抗体的方法。
- 使用HiBiT,无需抗体,消除了实验处理步骤,并最大限度地缩短了手动操作的时间。
- 易于定量及检测
- 无需封闭
- 与基于抗体的方法不同,没有背景,使用HiBiT印迹,检测试剂是否非特异性地结合到膜上并不重要,只有当它与带有HiBiT标记的蛋白质结合时,才会有发光信号。
4. 如何应用HiBiT标签
- 监测细胞内的蛋白丰度
- 蛋白降解研究
- 监测受体内化
- 插入并检测CRISPR敲入效率
5. 参考文献:
2) Schwinn, M.K. et al. (2020) A Simple and Scalable Strategy for Analysis of Endogenous Protein Dynamics. Sci. Rep. 10(1), 8953.
3) Tange, N. et al. (2020) Staurosporine and venetoclax induce the caspase-dependent proteolysis of MEF2D-fusion proteins and apoptosis in MEF2D-fusion (+) ALL cells. Biomed Pharmacother. 128, 110330.
4) Ranawakage D.C. et al.(2019) HiBiT-qIP, HiBiT-based quantitative immunoprecipitation, facilitates the determination of antibody affinity under immunoprecipitation conditions. Sci. Rep. 9(1) 6895.
5) Sasak, M. et al. (2018) Development of a rapid and quantitative method for the analysis of viral entry and release using a NanoLuc luciferase complementation assay. Virus Res. 243, 69-74.
6) Tamura, T. et al. (2019) In Vivo Dynamics of Reporter Flaviviridae Viruses. J Virol. 93(22), e01191-19.
Anti-HiBiT单克隆抗体
1. HiBiT标签蛋白的免疫检测
HiBiT是一个由11个氨基酸构成的肽标签,可以使用传统克隆技术或CRISPR/Cas9基因组编辑技术连接到目的蛋白中,使其能够在内源性表达条件下分析蛋白质。HiBiT标签蛋白通常通过添加Nano-Glo® HiBiT检测试剂产生的生物发光信号进行检测,从而在线性动态范围内(>7个数量级),对变化的蛋白质水平,进行准确定量。兼容高灵敏度和特异性的Anti-HiBiT Monoclonal Antibody,扩充了HiBiT标签蛋白的检测,使传统的基于抗体的方法可以检测HiBiT标签,无需串联标签方法。
2. 优势及应用
- 用正交法验证生物发光结果
- 在CRISPR/Cas9 HiBiT敲入后,在细胞池或克隆中确认内源性HiBiT标记蛋白的亚细胞定位
- 使用经典的Western blot检测确定蛋白水平和大小
- 对HiBiT标记蛋白进行免疫沉淀
- 对活细胞(细胞外HiBiT)或固定细胞(细胞内HiBiT)进行FACS分析
3. 数据展示
利用免疫印迹特异性检测低于皮克级的HiBiT
| Anti-HiBiT Monoclonal Antibody兼容高灵敏度和特异性,能够在免疫印迹中,在极低的背景下,检测低于皮克级的HiBiT标签蛋白。 利用Anti-HiBiT Monoclonal Antibody进行免疫印迹分析具有灵敏度高且特异性强的特点。在K562哺乳动物细胞裂解物中连续稀释HaloTag®-HiBiT蛋白,生成0.125~4pg的HiBiT标签蛋白。经过SDS-PAGE后,将凝胶转移至PVDF膜上,使用1µg/ml的一抗、0.2µg/ml的HRP偶联二抗以及ECL免疫印迹底物进行免疫印迹分析。成像60分钟,亮度1200~15000。 |  |
CRISPR/Cas9 HiBiT敲入后的亚细胞定位
使用Anti-HiBiT Monoclonal Antibody进行免疫荧光染色,可对HiBiT敲入细胞系池和细胞系克隆进行表征,证实内源性表达的HiBiT标签蛋白其亚细胞定位符合预期。
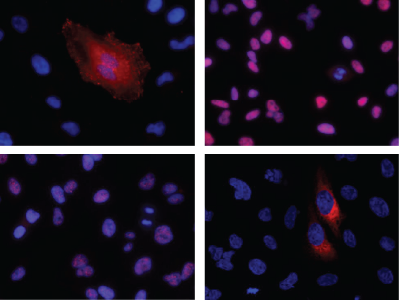
利用Anti-HiBiT Monoclonal Antibody在CRISPR编辑的细胞系池和细胞系克隆中进行HiBiT标签蛋白的免疫荧光检测。CRISPR/Cas9编辑用于在具有不同亚细胞定位的蛋白质的内源性位点处敲入HiBiT。利用Anti-HiBiT Monoclonal Antibody(红色)和Hoechst染料(蓝色)进行免疫荧光染色,再利用免疫荧光染色对固定的CRISPR修饰的细胞系克隆或细胞系池进行成像,包括图A:VCL-HiBiT池、图B:HDAC2-HiBiT克隆、图C:SMARCA4-HiBiT 克隆、图D:HSP90B1-HiBiT池。
抗HiBiT抗体与普通表位标记抗体效果相似或更优
HiBiT标签蛋白的免疫印迹检测和免疫沉淀表明,当使用普通抗体时,HiBiT标签蛋白的特异性检测和有效pull-down分析效果与FLAG®、Myc或HA标签相似,或是更优。

将使用Anti-HiBiT Monoclonal Antibody的免疫印迹检测与使用普通表位标签抗体进行比较。利用单独的HiBiT或HiBiT和单个拷贝的Myc、HA和FLAG®标签,或三个拷贝的FLAG®标签,将HSP90B1在HeLa细胞的C端进行标记。通过SDS-PAGE分离来自带标签的HSP90B1细胞池的裂解物(10µg)。转移到PVDF膜后,用1µg/ml抗-HiBiT或抗-Myc、0.1µg/ml抗HA或10µg/ml抗FLAG®一抗(如图所示)和0.4µg/ml抗小鼠或抗大鼠(用于抗HA印迹)二抗和ECL底物进行免疫印迹,曝光时间为5分钟。HiBiT抗体成像的亮度为0~29817,所有其他成像的亮度均为145~735。
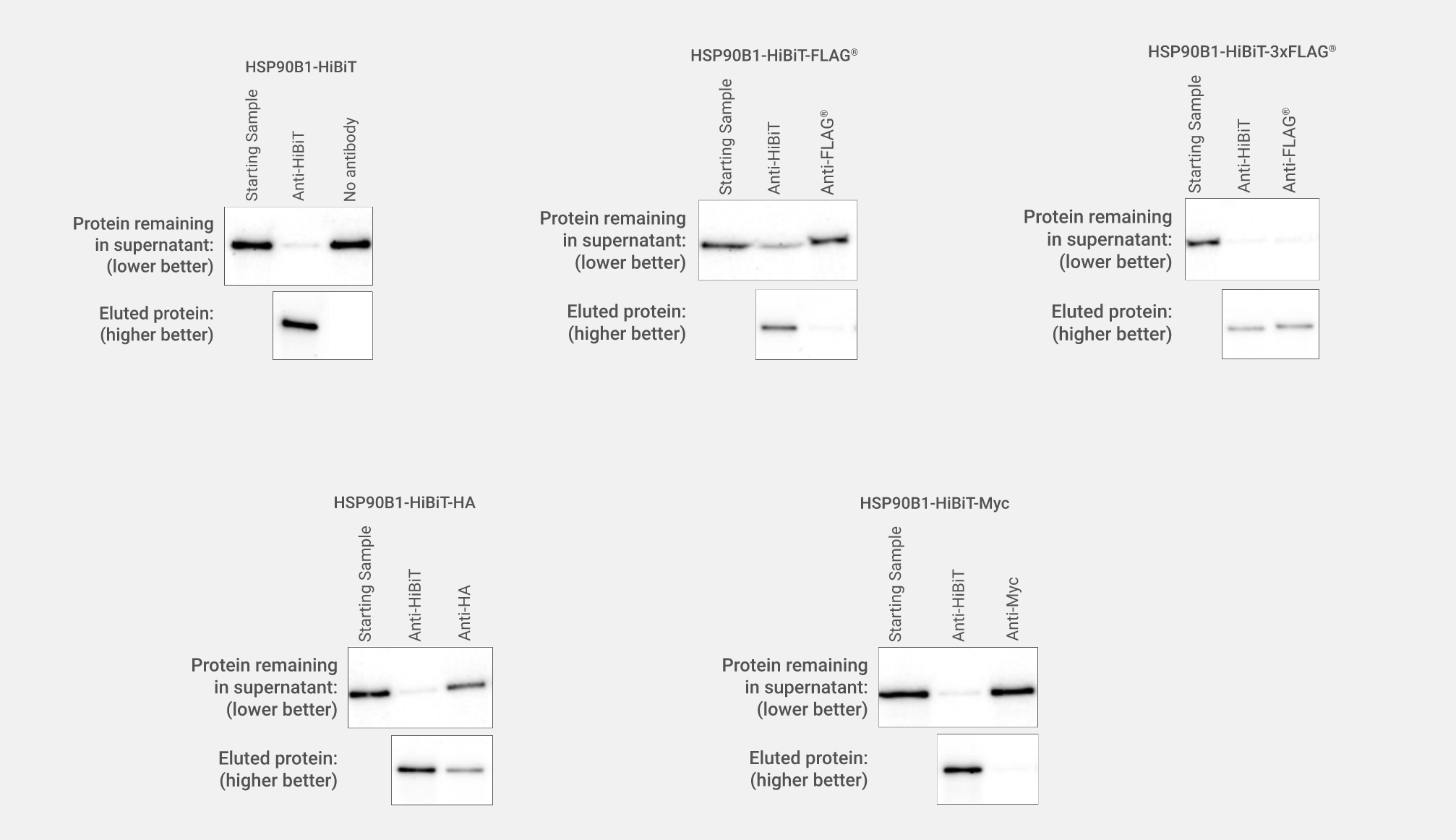
比较CRISPR修饰的细胞系池的pull-down效率。CRISPR/Cas9基因编辑用于将HiBiT、HiBiT FLAG、HiBiT-3XFLAG、HiBiT-HA或HiBiT-Myc敲入 HSP90B1蛋白内源性位点的C端。用缓冲液将CRISPR编辑的HeLa细胞系池裂解物进行稀释,随后进行分离,生成等效样本进行pull-down比较分析。使用2µg抗-HiBiT、FLAG®、HA或Myc抗体(如图所示)与蛋白G磁性树脂(Cytiva) 对HSP90B1蛋白进行免疫沉淀反应。经过2小时孵育后,清洗树脂,通过在SDS加样缓冲液中加热洗脱蛋白质。使用Nano-Glo® HiBiT Blotting System,对细胞裂解物中免疫沉淀的HSP90B1标签蛋白进行定量检测。显示了洗脱的蛋白质和保留在上清液中的蛋白质。通过比较抗体处理后的上清液与起始样本中的信号强度表明了抗体的蛋白清除效率。











