效能检测
Potency Testing
为确保CAR-T细胞疗法的有效性,功能性效力检测被用于评估CAR-T细胞识别和清除癌细胞的能力。我们已经开发了针对药物物质(即CAR和TCR载体及病毒衣壳)以及药物产品(即CAR-T和TCR-T)的效力检测方法。CAR-T功能性效力检测涉及将CAR-T细胞与靶癌细胞共培养,并测定关键功能结果,例如靶细胞杀伤。这些检测在肿瘤学中CAR-T细胞疗法的开发、表征和质量控制中发挥着至关重要的作用。
靶细胞杀伤(TCK)
利用效应细胞靶向杀伤肿瘤或感染细胞是许多免疫治疗药物的主要作用机制。因此,在药物开发时,证明其对靶细胞具有强大的特异性杀伤能力是十分必要的。传统的细胞毒性检测并不能区分靶细胞和效应细胞。另外,靶细胞特异性检测通常费时耗力,需要放射性或荧光标记。
HiBiT Target Cell Killing生物检测平台是简单、均质型的方法,灵敏度较高,提供了一个可靠的检测窗口。该平台可特异性检测多种生物药物诱导的靶细胞杀伤,包括mAbs、双特异性Abs和CAR-T细胞。这些检测方法提供的是经改造的表达HiBiT融合蛋白的常用的靶细胞。杀死靶细胞后,会产生明亮的发光信号。
 |  |
延长检测孵育时间可显示系列TCK活性。利用CAR-19或GFP对照慢病毒转染的T细胞效应细胞会以不同的效靶比(E∶T)与HiBiT靶细胞(Ramos)共培养。在孵育24小时(图A)或48小时(图B)后,添加NanoBiT®Extracellular Detection Reagent,可在GloMax®Discover微孔板读数仪上读取发光信号。EC50随时间左移,显示在较低的E:T比下连续的TCK活性。
T细胞重定向慢病毒CAR载体的效力检测
在CAR-T细胞生产中使用的慢病毒载体,监管机构建议除了检测病毒载体在CAR-T细胞中的转基因表达外,还需要额外的效力评估措施。为满足这一需求,我们开发了一种基于作用机制(MoA)的效力检测方法,用于测量T细胞重定向慢病毒载体的CAR与靶细胞的结合。该生物检测方法提供了一种稳定性指示的定量萤光信号读出,可轻松整合到您的CAR-T工作流程中。
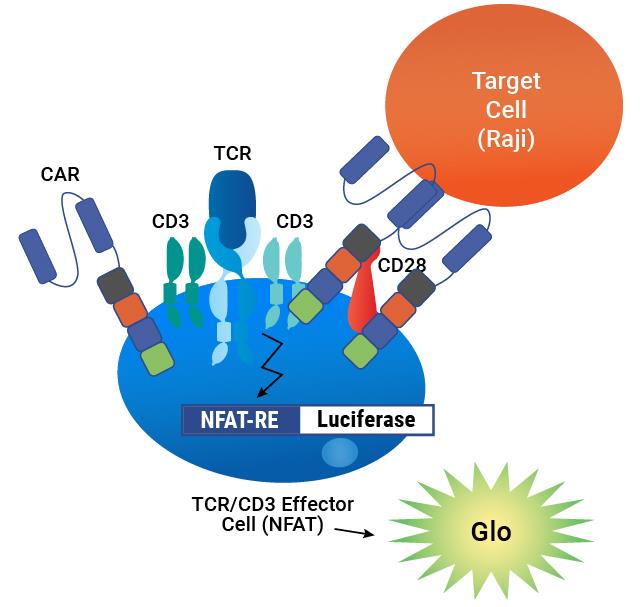 | 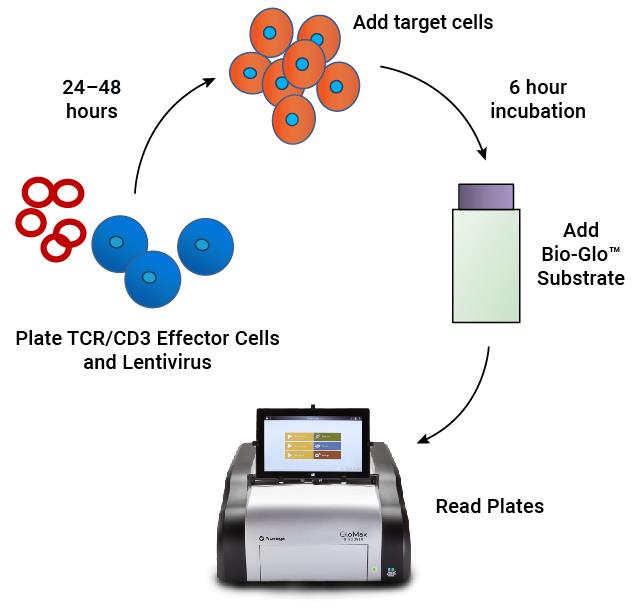 |
| 检测原理:CAR(嵌合抗原受体)被表达在含有NFAT-萤光素酶报告基因的TCR/CD3效应细胞表面。当CAR与靶细胞上的抗原结合时,会根据信号传导的强度成比例地诱导发光。 | 检测流程:将TCR/CD3效应细胞与CAR慢病毒在96孔板中混合。经过24-48小时的孵育后,加入表达抗原的靶细胞。经过6小时诱导后,加入Bio-Glo™底物并定量检测发光信号。 |
慢病毒生物活性检测特异性数据展示
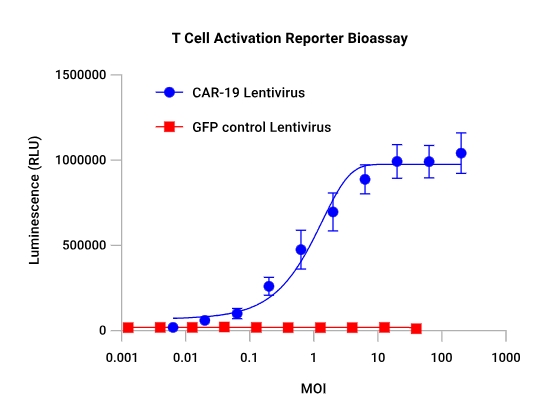 | 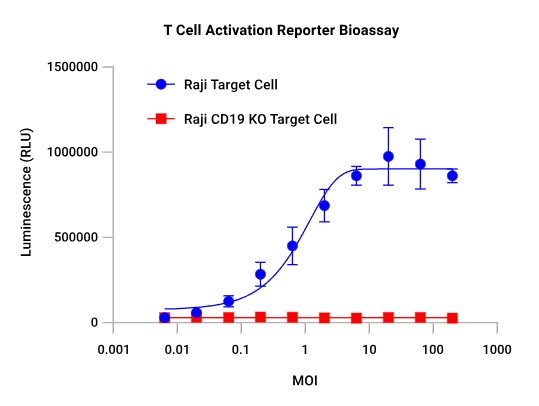 |
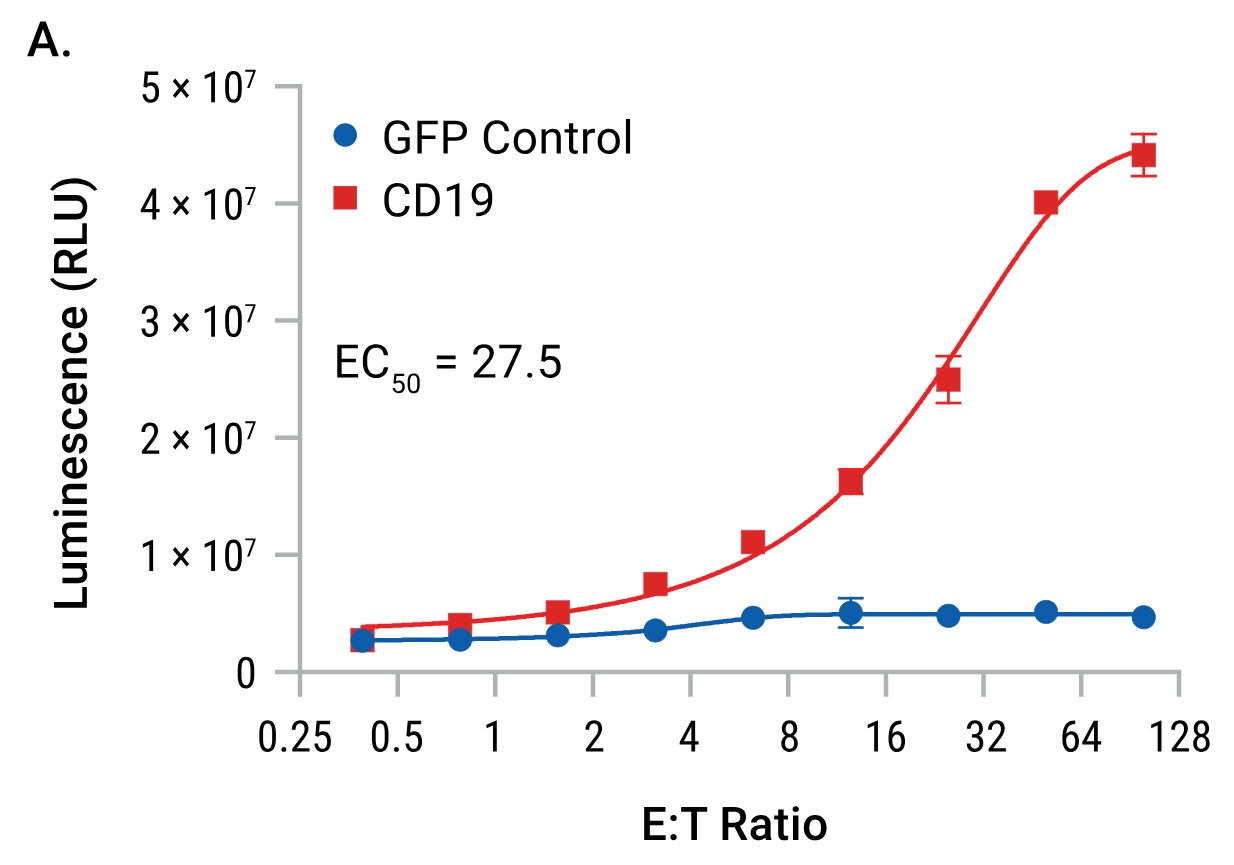
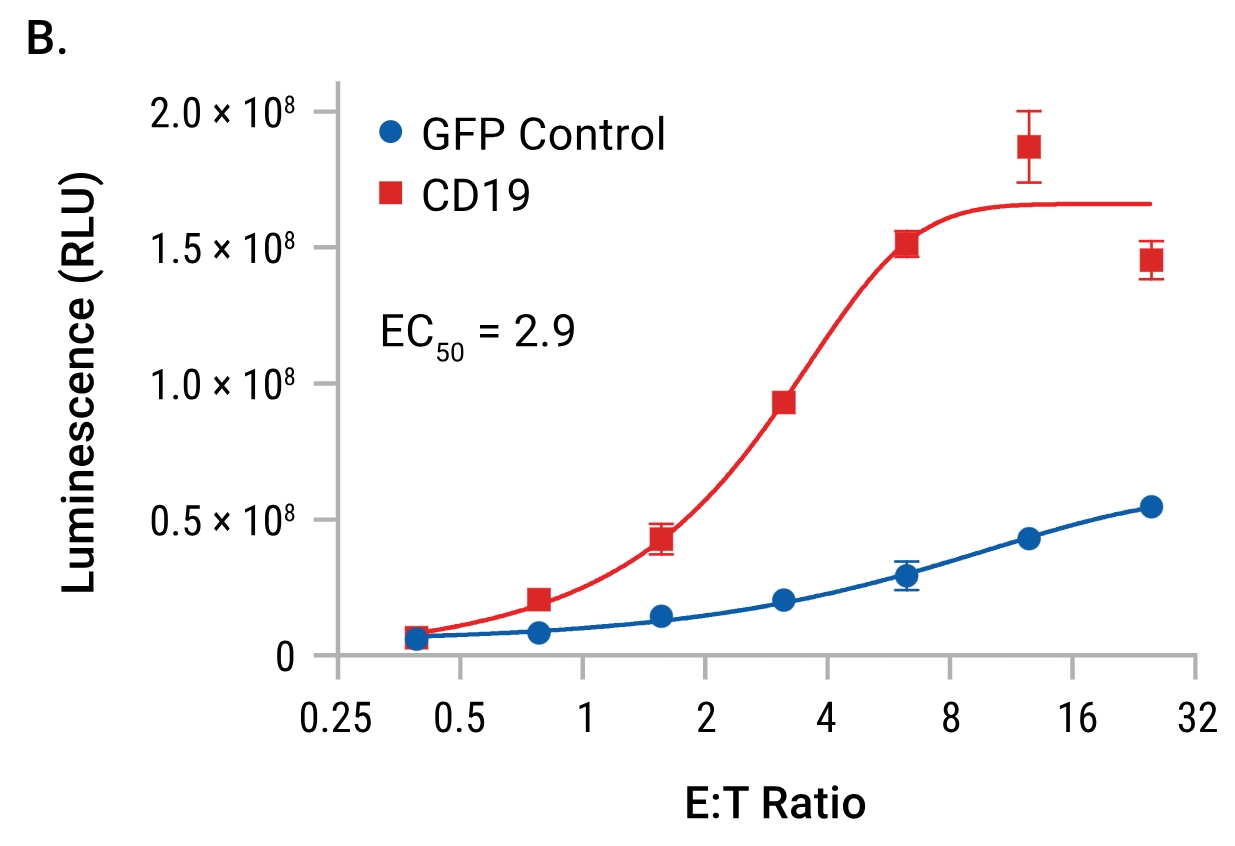
| CAR-19慢病毒转导细胞的特异性反应:TCR/CD3效应细胞分别用CAR-19慢病毒或GFP慢病毒进行一系列稀释后的转导。48小时后,加入Raji靶细胞(CD19+),并在6小时诱导后检测发光信号。只有用CAR-19慢病毒转导的TCR/CD3效应细胞对Raji靶细胞产生了反应。 | 抗原敲除验证检测的特异性:TCR/CD3效应细胞用一系列稀释浓度的CAR-19慢病毒进行转导。48小时后,分别加入Raji靶细胞或CD19基因敲除的Raji靶细胞,并在6小时诱导后检测发光信号。抗原的敲除消除了对靶细胞的反应,从而证明了检测的特异性。 |
慢病毒生物活性检测稳定性数据展示
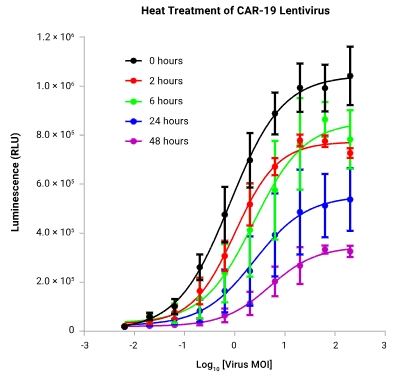 | 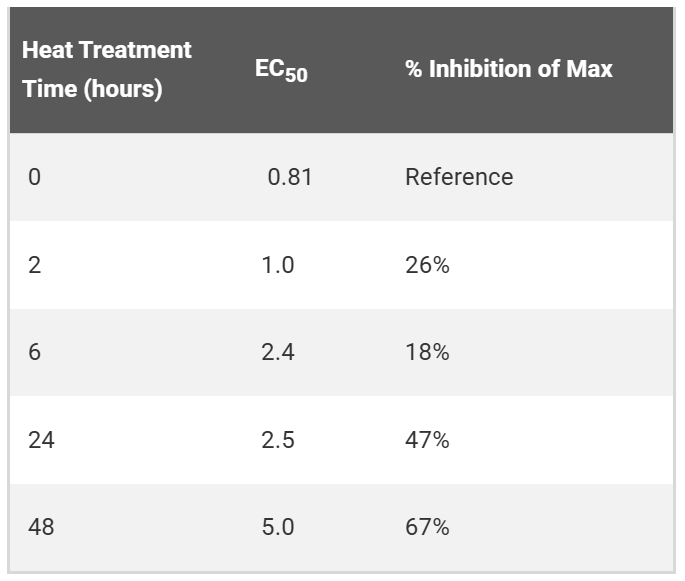 |
| | 为了研究CAR-19慢病毒的稳定性,实验通过在37℃下孵育2至48小时制备了CAR-19慢病毒的强制降解样品。随后,使用TCR/CD3效应细胞和Raji靶细胞(CD19+)进行生物检测。结果显示,随着热处理时间的延长,CAR-19慢病毒的效力显著降低,表现为EC50值升高和最大反应程度降低。这一结果表明,热处理导致慢病毒的活性下降,进一步证明了该检测方法能够有效指示慢病毒的稳定性。 |

